
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тема 9. Гидрологические процессы и явления
|
|
На рис 9.1 приводится разрез речной долины с указанием возраста горных пород. Необходимо назвать элементы речной долины в пределах разреза,и объяснить возможные условия их образования. Определить возможные причины и процессы формирования ручной долины в соответствии с заданным по вариантам рисункам разреза.
Пример ответа на поставленные вопросы по варианту №1
В поперечном сечении речной долины рис 9.1. выделяется русло 1,пойма 2,заливаемая во время паводков и половодья, первая 3 и вторая 4 надпойменные террасы,коренной берег -5.В посленеогеновое время, но до позднечетвертичной эпохи, речная долина в районе разреза испытала тектонический подъем либо существенно опустился базис эрозии реки, о чем свидетельствует глубокий эрозионный врез в неогеновых известняках.Во времена когда уровень реки был на отметке второй надпойменной террасы, скорость тектонического подъема резко снизилась,что способствовало усилению боковой эрозии долины реки с образованием эрозионных террас -4. В позднечетвертичную эпоху произошло тектоническое опускание местности сменившееся новым подъемом. В этот период происходит формирование мощной толщи аллювиальных отложений Q3 которые в дальнейшем были размыты.Остатки этих отложений формируют первую надпойменную террасу. В современную
эпоху территория долины испытала опускание,что привело к накоплению современного аллювия Q4,слагающего пойму и русло реки.
Рис 9.1.
| Номер варианта | Номер рисунка | Номер варианта | Номер рисунка | |
| 9.1-а | 9.1-д | |||
| 9.1-б | 9.1-е | |||
| 9.1-в | 9.1- ж | |||
| 9.1-г | 9.1- з |
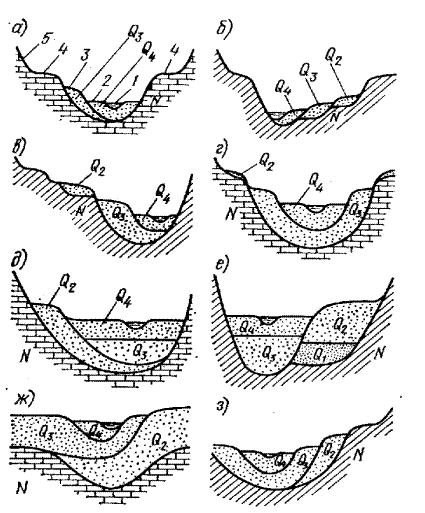
Рис 9.1 Схема разрезов речных долин
Тема 10. ХИМИЧЕСКИЙ СОСТАВ ВОДЫ
10.1. Основные понятия
Изучение химического состава и физических свойств природных вод имеет большое экологическое и практическое значение для различных отраслей народного хозяйства. Химический состав воды необходимо учитывать при использовании её для всех видов водоснабжения (питьевого, технического, лечебного). При строительстве различных сооружений необходимо располагать данными о химическом составе воды, чтобы предпринять меры против коррозии бетона. Химический состав характеризует качество воды, используемой при орошении; по её составу судят об интенсивности процессов засоления орошаемых массивов. Тщательно изучают химический состав подземных вод при организации добычи солей иода, брома, бора, а также при гидрохимических методах поисков полезных ископаемых. Химический состав подземных вод необходимо знать и для изучения условий происхождения и формирования подземных вод.
К физическим свойствам подземных вод относятся плотность, температура, прозрачность, цвет, запах, вкус, привкус, электропроводность и радиоактивность.
Свойства вод определяются количеством и соотношением содержащихся в них различных ионов, некоторых недиссоциированных соединений, газов, органических веществ, реакцией воды (рН), жесткостью, общей минерализацией.
К главным химическим компонентам воды относятся: хлор-ион Cl-, сульфат-ион SO42-, гидрокарбонатный HCO3- и карбонатный CO32- ионы, а также ионы щелочных и щелочноземельных металлов и окислов - натрия Na+ и калия К+, кальция Са2+ и магния Mg2+, железа и кремния SiO2 (в коллоидном состоянии).
Экологи, занимающиеся изучением химического состава вод, должны иметь определенные навыки по обработке и систематизации данных о химическом составе воды.
10.2. Обработка химических анализов воды
Чтобы сделать необходимые выводы из полученных результатов анализа, следует систематизировать данные, позволяющие правильно судить о химическом составе воды.
В природной воде молекулы солей почти полностью диссоциированы на ионы, поэтому основной формой выражения результатов анализа воды является ионная. Содержание того или иного иона при лабораторных исследованиях выражается в граммах или миллиграммах в 1 л. Данные лабораторных анализов подземных вод в мг/л или г/л подлежат дальнейшей обработке:
1. Данные анализа пересчитываются в эквивалентную и процент-эквивалентную формы.
2. Вычисляют ошибки анализа, %.
3. Определяют все виды жесткости воды.
4. Классифицируют воду по величине общей жесткости, минерализации, активной реакции.
10.2.1. Пересчет анализа из ионной формы в процент- эквивалентную и вычисление ошибки анализа. Для пересчета данных анализа из ионной формы в миллиграмм- эквивалентную необходимо количество миллиграммов каждого иона в 1 л воды разделить на его эквивалентную массу (ионная масса, деленная на валентность). Для упрощения расчетов можно использовать пересчетные множители, которые представляют собой величину, обратную эквивалентной массе (табл. 10.1).
Таблица 10.1
Эквивалентные массы ионов и множители для пересчета
миллиграмм-ионов на миллиграмм- эквиваленты
| Катионы | Эквива- лентная масса | Множитель для пересче- та | Анионы | Эквива- лентная масса | Множитель для пересче та |
| H+ | 1,008 | 0,99206 | Cl- | 35,457 | 0,02820 |
| K+ | 39,096 | 0,02558 | Br- | 79,916 | 0,01251 |
| Na+ | 22,997 | 0,04348 | I- | 126,91 | 0,00788 |
| NH4 | 18,040 | 0,05543 | NO3- | 62,008 | 0,01613 |
| Li+ | 6,940 | 0,14409 | NO2- | 46,008 | 0,02174 |
| Ca2+ | 20,040 | 0,04990 | SO42- | 48,033 | 0,02082 |
| Fe2+ | 27,925 | 0,03581 | HCO3- | 61,018 | 0,01639 |
| Fe3+ | 18,617 | 0,05371 | CO32- | 30,005 | 0,03333 |
| Al3+ | 8,993 | 0,11124 | PO43- | 31,658 | 0,03159 |
| Mn2+ | 27,465 | 0,03641 | HPO42- | 47,994 | 0,02084 |
| H2PO42- | 96,996 | 0,01031 | |||
| S2- | 16,033 | 0,06237 | |||
| HS- | 33,074 | 0,03024 | |||
| HSiO3- | 77,098 | 0,01298 | |||
| SiO32- | 38,045 | 0,02630 |
Результаты определений для массовых анализов рекомендуется выражать в мг/л и %. экв целыми числами, а в мг.экв/л - с точностью до второго десятичного знака.
Контроль результатов анализа воды проводится по эквивалентному содержанию ионов или по сухому остатку. Первый метод может быть применим только для полных, а второй - для полных и сокращенных химических анализов.
Процент погрешности анализа вычисляют по формуле
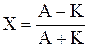 , (10.1)
, (10.1)
где А и К - суммы миллиграмм-эквивалентов соответственно анионов и катионов.
Ниже приводится допустимая погрешность при массовых анализах.
Таблица 10.2
| Минерализация воды, мг . экв/л анионов | Погрешность, ± относит. % |
| > 15 | |
| 5-15 | 2-5 |
| 3-5 | 5-10 |
| < 3 | не установлена |
Контроль по сухому остатку заключается в сравнении сухого остатка с суммой всех растворенных веществ в виде ионов и молекул. При подсчете необходимо брать половину количества HCO3-, так как при высушивании сухого остатка гидрокарбонаты переходят в карбонаты по уравнению:
НСО3- ® СО32- + СО2 + Н2О. (10.2)
Для пересчета результатов анализа из миллиграмм-эквивалентов в процент- эквиваленты необходимо сумму миллиграмм-эквивалентов катионов и анионов принять порознь за 100% и вычислить процентное содержание каждого иона в отдельности.
Таблица 10.3
Пример выражения результатов анализа воды
в различных формах
| Ионы | мг/л | мг . экв/л | % . экв |
| Катионы: Na+ K+ Ca2+ Mg2+ | 10,4 0,15 3,8 2,8 | ||
| Итого: | 17,15 | ||
| Анионы: Cl- SO42- HCO3- | 7,5 4,5 4,7 | ||
| Итого: | 16,7 |
В сокращенном анализе вычисленная по разности сумма эквивалентов щелочных металлов (К+ + Na+) условно пересчитывается на натрий.
10.2.2. Определение жесткости воды
Под жесткостью понимается свойство воды, обусловленное присутствием в ней солей кальция и магния. Выражается жесткость в
мг . экв/л. Различают пять видов жесткости: общую, устранимую (или временную); неустранимую (или постоянную), карбонатную и некарбонатную.
Общая жесткость обусловлена наличием всех солей кальция и магния и вычисляется путем суммирования мг . экв этих ионов.
Устранимая (временная) и карбонатная жесткости обусловлены одними и теми же гидрокарбонатными и карбонатными солями кальция и магния, но имеют различное значение. Устранимая жесткость - величина экспериментальная. Она показывает, на сколько уменьшается общая жесткость воды после кипячения. Карбонатная жесткость - величина расчетная, численно равная количеству мг . экв гидрокарбонатных и карбонатных ионов, содержащихся в воде. Если это количество больше, чем общая жесткость, карбонатную жесткость считают равной общей жесткости.
Неустранимая (постоянная) и некарбонатная жесткости обусловлены хлоридами, сульфатами и другими некарбонатными солями кальция и магния. Неустранимая жесткость равна разности между общей жесткостью и устранимой (временной), а некарбонатная жесткость равна разности между общей жесткостью и карбонатной.
Природные воды по общей жесткости Алексин О. А. подразделяет на пять групп. Ниже дается оценка природных вод по степени жесткости.
Таблица 10.4
| Оценка воды | Жесткость, мг . экв |
| Очень мягкая | до 1,5 |
| Мягкая | 1,5 - 3 |
| Умеренно-жесткая | 3 - 6 |
| Жесткая | 6 - 9 |
| Очень жесткая | выше 9 |
Пример. Вычислим все виды жесткости по данным анализа воды, приведенным в табл. 10.3.
1. Общая жесткость равна: Н = [Cа2+] + [Mg2+] = 3,8 + 2,8 =
6,6 мг . экв.
Карбонатная жесткость равна 4,7 мг . экв. Некарбонатная жесткость равна 6,6 - 4,7 = 1,9 мг . экв. Следовательно, по степени жесткости согласно классификации Алексина О.А. вода относится к жесткой.
10.2.3. Минерализация воды
Под минерализацией может подразумеваться одна из следующих величин: экспериментально определенный сухой (плотный) остаток; сумма ионов; сумма минеральных веществ; вычисленный сухой остаток. Сумма минеральных веществ - более полное выражение минерализации воды по сравнению с суммой ионов, так как она учитывает и недиссоциированные и неорганические вещества (SiO2, Fe2O3 и др.). Ниже приводится общая минерализация подземных вод в градациях, выделенных на основании классификации природных вод В.И.Вернадского и согласующихся с требованиями практического использования подземных вод.
Таблица 10.5
| Группа | Минерализация, г/л |
| Пресные | до 1 |
| Слабосолоноватые | 1-3 |
| Сильносолоноватые | 3-10 |
| Соленые | 10-50 |
| Слабые рассолы | 50-100 |
| Крепкие рассолы | > 100 |
Согласно данным анализа, приведенным в табл. 10.5, минерализация воды составляет (по сумме ионов): 240+6+77+34+265+218+286=1126 мг/л, или 1,1 г/л. Вода по степени минерализации относится к слабосолоноватой.
10.2.4. Реакция воды
Реакция воды выражается показателем рН, который представляет собой десятичный логарифм концентрации Н+, взятый с положительным знаком: рН=- lg[Н+]. По величине активной реакции рН классифицируются следующим образом:
Таблица 10.6
| Наименование воды | рН |
| Очень кислая | < 5 |
| Кислая | 5-7 |
| Нейтральная | |
| Щелочная | 7-9 |
| Высокощелочная | > 9 |
Агрессивность вод. Подземные воды обладают в той или иной степени свойством агрессивности по отношению к бетону, железобетону и металлам. Агрессивность обусловлена присутствием ионов водорода, свободной углекислоты, сульфатов и магния.
Различают несколько видов агрессивности: выщелачивания, общекислотную, углекислую, сульфатную, магнезиальную.
Агрессивность выщелачивания определяется по величине карбонатной жесткости воды. Вода считается агрессивной по отношению к бетону при карбонатной жесткости свыше 0,54 - 2,14 мг . экв/л в зависимости от типа цемента в составе бетона.
Агрессивность общекислотная определяется по количеству водородных ионов (по рН). Вода считается агрессивной для всех типов цементов в пластах высокой водопроводимости: а) при рН < 7 и карбонатной жесткости меньше 8,6 мг . экв/л; б) при рН < 6,7 и карбонатной жесткости больше 8,6 мг . экв/л. Для слабопроницаемых пластов вода считается агрессивной при рН<5.
Агрессивность сульфатная оценивается по содержанию в воде ионов SO42-, мг/л. В породах высокой проводимости для бетона на портландцементе вода считается агрессивной при содержании ионов Cl- и SO42- мг/л:
| Cl- | SO42- 
|
| 0-3000 | 250-500 |
| 3001-5000 | 501-1000 |
| > 500 | >1000 |
В породах слабой водопроводимости вода считается агрессивной при содержании иона SO4> 1000 мг/л, для бетонов на пуццолановом, шлаковом и песчано-пуццолановом портландцементе - при содержании иона SO42-> 4000 мг/л независимо от содержания иона Cl-.
Агрессивность магнезиальная определяется по наличию в воде ионов Мg2+. Для портландцемента, находящегося в сильнопроницаемых породах, вода считается агрессивной при содержании иона Мg2+ > 5000 мг/л, для других видов цемента - при содержании иона Mg2+ более величин, приведенных ниже, мг/л:
| SO42- | Mg2+ |
| 0-1000 | > 5000 |
| 1001-2000 | 3001-5000 |
| 2001-3000 | 2001-3000 |
| 3001-4000 | 1000-2000 |
Пример. Требуется определить агрессивность воды - среды по отношению к бетонной напорной конструкции, расположенной в грунте, обладающем повышенной водопроводимостью. Исходные данные помещены в табл. 10.7.
Таблица 10.7
| Содержание | |||
| Ионы | мг/л | мг . экв/л | Дополнительные показатели |
| Катионы: N+ + K+ (по разн.) Ca2+ Mg2+ | 84,8 7,5 16,4 | CO2 свободная - 119 мг/л | |
| Анионы: Cl- SO42- HCO3- | 18,6 84,3 7,9 | рН - 6,6 Карбонатная жест- кость 7,9мг . экв. |
По приведенным данным вода обладает выщелачивающей агрессивностью по отношению к бетону на любом цементе, так как карбонатная жесткость (7,9 мг . экв) превышает допустимую норму (2,4 мг . экв) и не обладает общекислотной агрессивностью, так как рН < 6,7, а карбонатная жесткость < 8,6 мг . экв. Она обладает также и сульфатной агрессивностью, так как содержание иона SO42- превышает 500 мг/л при содержании иона Cl- до 3000 мг/л.
Магнезиальной агрессивностью вода не обладает, так как содержание иона Mg2+ не превышает 1000 мг/л.
10.3. Выражение химического состава воды в виде формул
Для изображения химического состава воды наиболее часто используют формулу Курлова М. Г., которая представляет собой псевдодробь, в числителе которой записывают анионный состав воды (в %-экв) в убывающем порядке, а в знаменателе - катионный. В отличие от формулы солевого состава запись ионов, содержание которых составляет менее 10%-экв в формуле Курлова М. Г., не производят. Перед дробью записывают содержание газов и специфических элементов, если они имеются в воде, и общую минерализацию М в г/л. После дроби указывают температуру воды и дебит источника или скважины, если эти данные имеются. Название воды записывают через черточку: сначала анионный, а затем катионный составы, вошедшие в формулу.
Пример. Необходимо выразить химический состав воды в виде формулы Курлова, дать наименование воды, её жесткости по результатам химического анализа воды.
Таблица 10.8
| Содержание основных ионов, мг/л | ||||||||
| Сухой остаток, мг/л | рН | Темпе- ратура оС | HCO3- | SO42- | Cl- | Na+ | Ca2+ | Mg2+ |
| 7,3 |
Пересчет результатов химического анализа (табл. 8.8) в мг-экв и %-экв приводится в табл. 8.9.
Таблица 10.9
| Содержание | Содержание | ||||||
| Анионы | мг/л | мг-экв/л | % -экв | Катионы | мг/л | мг-экв/л | %-экв |
| HCO3- | 15,25 | Na+ | 4,05 | ||||
| SO42- | 1,58 | Ca2+ | 9,68 | ||||
| Cl- | 0,68 | Mg2+ | 3,70 | ||||
| Итого... | 17б51 | Итого... | 17,43 |
В данном случае формула имеет вид:
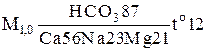 . (10.3)
. (10.3)
По этой записи воду следует называть пресной, гидрокарбонатно-кальциево -натриево-магниевой, холодной. Классификация воды по общей минерализации и температуре приведена выше по тексту.
Общую жесткость определяют как сумму катионов кальция и магния, выраженных в мг- экв/л: 9,68+3,70=13,38 мг-экв/л. По этому показателю вода классифицируется как очень жесткая. Карбонатную жесткость определяют по содержанию гидрокарбонат -иона. В связи с тем, что HCO3=15,25 мг-экв/л > Ca2++ Mg2+=13,38 мг- экв/л, карбонатная жесткость равна общей, а некарбонатная (остаточная) жесткость отсутствует.
Учитывая общую минерализацию, химический состав, содержание ионов водорода (рН), температуру и вычисленную жесткость, окончательно дают воде наименование: пресная, гидрокарбонатно-кальциево -натриево-магниевая, холодная, щелочная, очень жесткая.
10.4. Оценка качества воды для питьевого и хозяйственного
водоснабжения
Вода, используемая для хозяйственно-питьевого водоснабжения, должна удовлетворять требованиям ГОСТ “Вода питьевая”. В ГОСТе даются предельные нормы для питьевой воды: 1) бактериальных показателей, 2) общих физических и химических показателей, 3) токсических веществ.
О санитарном состоянии питьевой воды судят по трем показателям: 1) количеству колоний, которые вырастают в 1 мг неразбавленной воды после помещения ее в питательную среду;
2) коли- титру, т. е. по количеству воды в мл, в котором обнаруживается одна кишечная палочка; 3) коли –индексу, т. е. по количеству кишечных палочек в 1 л воды.
Основные требования, предъявляемые к воде, используемой для хозяйственно-питьевого водоснабжения, приведены ниже (по ГОСТ 2874 - 73 и Плотникову Н.А., Сычеву К.И., 1976):
Таблица 10.10
| № п/п | Показатели | Предельное содержание |
| 1. | Мутность по стандартной шкале, мг/л | не >1,5 |
| 2. | Цветность по платино-кобальтовой шкале, град | не >20 |
| 3. | Запах при 20оС, балл | не >2 |
| 4. | Привкус при 20оС, балл | не >2 |
| 5. | Активная реакция, рН | 6,5-8,5 |
| 6. | Сухой остаток, мг/л | до 1000 |
| 7. | Общая жесткость, мг-экв/л | не >7 |
| 8. | Хлориды, Cl-, мг/л | не > 350 |
| 9. | Сульфаты, SO42-, мг/л | не > 500 |
| 10. | Железо, Fe2+– Fe3+, мг/л | до 0,3 |
| 11. | Марганец, Mn2+, мг/л | до 0,1 |
| 12. | Медь, Cu2+, мг/л | до 1 |
| 13. | Цинк, Zn2+,, мг/л | до 5 |
| 14. | Остаточный алюминий, Al3+, мг/л | до 0,5 |
| 15. | Свинец, Pb2+, мг/л | до 0,1 |
| 16. | Мышьяк, As3+,5+, мг/л | до 0,05 |
| 17. | Фтор, F: a) для I и II климатических районов, мг/л б) для III, мг/л в) для IУ, мг/л | до 1,5 до 1,2 до 0,7 |
| 18. | Бериллий, Be2+, мг/л | до 0,0002 |
| 19. | Молибден, Mo2+, мг/л | до 0,5 |
| 20. | Нитраты, по N, мг/л | до 10 |
| 21. | Аммиак, по N, мг/л | до 2,0 |
| 22. | Полиакриламид, мг/л | до 2,0 |
| 23. | Селен, Se2+, мг/л | до 0,001 |
| 24. | Стронций, Sr2+, мг/л | до 2 |
| 25. | Уран природный, U и уран-238, мг/л | до 1,7 |
| 26. | Радий 226, Ra, БК | до 14,8 |
| 27. | Стронций-90, БК | до 0,005 |
| 28. | Ртуть, Hg, мг/л | до 4,44 |
| 29. | Никель, Ni, мг/л | до 1,0 |
| 30. | Кобальт, Co, мг/л | до 1,0 |
| 31. | Кадмий, Cd, мг/л | до 0,01 |
| 32. | Цианиды (в расчете на циан), мг/л | до 0,1 |
| 33. | Барий, Ba2+, мг/л | до 4,0 |
| 34. | Нафтеновые кислоты, мг/л | до 0,3 |
| 35. | Фенолы, мг/л | до 0,001 |
| 36. | Хром, Cr6+, мг/л | до 0,1 |
| 37. | Хром, Cr3+, мг/л | до 0,5 |
| 38. | Некоторые ПАВ (АБС, ДНС и др.), мг/л | до 0,5 |
| 39. | Коли - индекс | до 300 |
Некоторые показатели (пункты 28-38) не вошли в ГОСТ, но они утверждены Министерством здравоохранения СССР 28 декабря 1973 г.
При отсутствии источника водоснабжения с пресной водой разрешается использовать воду с сухим остатком до 1500 мг/л при общей жесткости до 10 мг . экв/л. В каждом случае возможность использования таких вод для питьевого водоснабжения должно быть согласовано с органами санитарно-эпидемиологической службы.
Для производственного водоснабжения, орошения и обводнения могут быть использованы как пресные, так и солоноватые воды. Требования к качеству воды для этих целей устанавливаются водопотребителями или проектными организациями.
10.5. Задание
На основании данных, приведенных в таблице 10.11,по вариантам, провести пересчет и записать результат в виде формулы Курлова, дать название воды, дать ее классификацию по всем параметрам и ее пригодность для питьевого и хозяйственного водоснабжения.
Date: 2015-09-26; view: 1007; Нарушение авторских прав