
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методы ускоренного определения стабильности лекарственных средств
|
|
Рекомендуемые ГОСТом для определения стабильности ЛС долгосрочные испытания проводятся в реальном времени. Они заключаются в том, что ЛС в течение периода, отводимого на его реализацию (обычно от 2 до 5 лет), хранят при комнатной температуре. Через определенные промежутки времени оценивают качество хранящегося ЛС по ФС (ФСП). На основании результатов анализа делают заключение об оптимальном сроке хранения. Такой метод позволяет получить наиболее объективное заключение, но на проведение испытаний уходит несколько лет.
Используемые ускоренные испытания и стресс-тесты исследования стабильности ЛС основаны на определении их качества путем испытаний в более жестких условиях.
Методы ускоренного хранения (ускоренного старения) позволяют за 15-115 дней при 40-70°С установить сроки хранения, которые, как правило, совпадают с результатами, полученными при хранении Л В при комнатной температуре в течение 3-5 лет. Исследования ведут в климатических шкафах или комнатах, которые имеют устройства, позволяющие автоматически регулировать заданные условия хранения: температуру, влажность, свет. Оценку стабильности осуществляют, исследуя физические и химические изменения ЛВ.
Таким образом, методы ускоренного старения основаны на изучении кинетики реакций разложения лекарственных веществ. Используя факторы, ускоряющие химические реакции (температуру, свет, влагу, рН среды, кислород), можно в течение короткого промежутка времени количественно установить те изменения, которые происходят с ЛС при длительном хранении. Из перечисленных факторов чаще всего используют температуру. На основе полученных результатов устанавливают оптимальные параметры хранения ЛС: температурный режим, влажность, освещенность, рН среды, характер упаковки и т.д.
Цель исследования стабильности ЛС методами ускоренного хранения может быть различной. Если исследуется лекарственное вещество (субстанция), то устанавливают влияние температуры, света и других факторов на процесс разложения (скорость химических реакций). Для лекарственных форм также устанавливают влияние вспомогательных веществ, стабилизаторов и других компонентов на стабильность.
Выполнение исследований методом ускоренного старения осуществляют, запаивая образцы в стеклянные трубки или ампулы в количестве, необходимом для однократного испытания. При изучении влияния на стабильность ЛВ атмосферного кислорода выполняют сравнительные испытания при одинаковой температуре, но помещая одну порцию испытуемого ЛВ в открытый сосуд, а другую — в запаянную ампулу, из которой вытеснен воздух.
В течение всего эксперимента необходимо строгое соблюдение температурного режима, Для этого используют ультратермостаты, позволяющие поддерживать температуру на заданном уровне с точностью ±(0,2-1)°. При повышении температуры, как правило, ускоряются протекающие в Л В физико-химические процессы. Зависимость скорости реакции от температуры лежит в основе ускоренных методов старения и определяется либо правилом Вант-Гоффа, либо уравнением Аррениуса.
I, Наиболее простая методика определения сроков годности лекарственных веществ и лекарственных форм изотермическим методом основана па использовании правила Вант-Гоффа: при повышении температуры на 10°С скорость химической реакции возрастает в 2-4 раза. Это правило справедливо только для реакций, протекающих в сравнительно небольшом температурном интервале. Так как для установления сроков хранения обычно используют температурный интервал Ю°С и ведут исследования при температуре от 40 до 70°С, то правило Вант-Гоффа оказывается вполне приемлемым. На основании этого правила была разработана «Временная инструкция по проведению работ для определения сроков годности лекарственных средств на основе метода ускоренного старения при повышенной температуре».
Она определяет единый порядок экспериментального хранения ЛС при повышенной температуре с целью установления сроков их годности. Инструкция распространяется только на индивидуальные ЛВ (субстанции) и их ЛФ. Она не может быть использована для установления сроков годности растительного сырья, полипептидов, белковых, эндокринных и других ЛС биологического происхождения с неустановленной химической структурой или не имеющих определенного состава. Работу по установлению сроков годности в соответствии с инструкцией выполняют организации-разработчики пли предприятия-изготовители.
В соответствии с требованиями этой инструкции испытуемое ЛС в заводской упаковке подвергают воздействию температур, превышающих среднюю температуру его хранения. При этом сокращается промежуток времени, в течение которого происходят физические и химические процессы, приводящие к разрушению Л В в обычных условиях хранения до допустимых пределов (10%). При удачном подборе температурного интервала изменяются практически те же контролируемые показатели качества ЛВ, что и в условиях обычного хранения, но в значительно меньшем интервале времени. Это искусственное моделирование дает возможность в более короткие промежутки времени установить сроки хранения ЛС при 20-25'С. Кроме того, метод позволяет решать и другую задачу — найти температуру хранения, обеспечивающую заданный срок годности (для ЛВ, имеющих ограниченный срок годности при комнатной температуре).
Как правило, предельные температуры экспериментального хранения составляют 60°С для индивидуальных Л В, таблеток, капсул, присыпок (при высокой термической устойчивости этих ЛС она может быть и выше), 60°С — для инъекционных растворов, 40°С — для мазей, линиментов, шприц-тюбиков, 30°С — для суппозиториев и аэрозолей. При проведении испытаний влияние света на испытуемые образцы должно быть исключено.
Срок годности (С) при температуре хранения (Тхр) связан с экспериментальным сроком годности (С,) при температуре экспериментального хранения (Т,) зависимостью С = КСЭ,
где К — коэффициент соответствия:
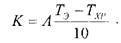
Исходя из правила Вант-Гоффа, температурный коэффициент скорости химической реакции (А) при увеличении температуры на 10°С принят равным А = 2.
Методы ускоренного старения, основанные на использовании уравнения Аррениуса, в зависимости от способа термостатирования делятся на изотермические и неизотермические. Суть изотермического метода, каки при использовании правила Вант-Гоффа, сводится к экспериментальному определению констант скорости химической реакции для нескольких фиксированных температур. Выбор последних осуществляют с таким расчетом, чтобы скорость протекающей реакции была приемлемой для выполнения эксперимента. С учетом порядка реакции рассчитывают время, в течение которого концентрация активного вещества уменьшается на 10%, при условии, что продукты разложения не токсичнее исходного соединения. Этот период времени принимают за срок годности данного JIC. Для выполнения испытаний изотермическим методом необходимо предварительно доказать идентичность процесса разложения при различных температурах. Зависимость скорости реакции от температуры определяется уравнением Аррениуса:
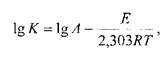
где К— константа скорости при некоторой температуре; Е — энергия активации, кДж/моль; Я — молярная газовая постоянная, равная 8,314 ДжДмоль • К); А — эмпирическая константа; Т— абсолютная температура.
Многочисленными экспериментами было установлено, что уравнение Аррениуса с достаточной точностью описывает зависимость скорости реакции от температуры в широком температурном интервале для реакций различных порядков.
Определение срока годности лекарственного средства с помощью уравнения Аррениуса осуществляют, выполняя следующие операции:
1. Определение константы скорости разложения ЛС и порядка реакции, которые устанавливают экспериментально по трем-четырем значениям температуры (обычно в интервале от 40 до 70°С). Для этого из смеси ЛВ (с известной начальной концентрацией) и продуктов его разложения через определенные промежутки времени отбирают пробы. В каждой из них устанавливают концентрацию испытуемого ЛВ и подставляют это значение в уравнения для констант скоростей реакций различных порядков. На основании сделанных вычислений устанавливают, в каком из уравнений полученная величина будет иметь постоянное значение. Постоянство значений констант скорости указывает на пригодность того или иного уравнения и соответственно на порядок реакции. Затем производят вычисление среднего значения констант скоростей при всех температурах опыта.
2. Построение графика зависимости в аррениусовых координатах — 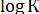 (1/Т). Используя полученные значения различных температурах, строят график зависимости между логарифмом константы скорости реакции (К) и обратным значением абсолютной температуры (1/Т). Прямолинейная зависимость графика позволяет путем экстраполяции определить значения для 20°С (или другой заданной температуры) с последующим вычислением значения константы скорости К.
(1/Т). Используя полученные значения различных температурах, строят график зависимости между логарифмом константы скорости реакции (К) и обратным значением абсолютной температуры (1/Т). Прямолинейная зависимость графика позволяет путем экстраполяции определить значения для 20°С (или другой заданной температуры) с последующим вычислением значения константы скорости К.
Константу скорости реакции разложения ЛВ можно рассчитать не только по графику, но и по выведенной из уравнения Аррениуса формуле:
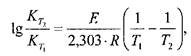
где Кт1 и Кт2 — константы скорости реакции при температурах T1 и T2.
Определив константу скорости реакции при более высокой температуре Т2, можно рассчитать константу скорости для комнатной (или другой заданной) температуры Тк. При расчетах исходят из предположения, что энергия активации Е для данной реакции не зависит от температуры (или меняется незначительно).
3. Расчет энергии активации Е процесса разложения исследуемого Л В и вычисление эмпирической константы А уравнения Аррениуса.
По двум константам скорости реакции К1 и К2 (при условии, что К1 > К2), соответственно установленным при двух различных температурах Т1 и Т2(Т1> Т2), вычисляют энергию активации Е:
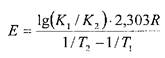
4. Вычисление времени разложения ЛВ (при заданной температуре) по соответствующему кинетическому уравнению и полученной величине К. По найденному значению «t»рассчитывают время и в течение которого происходит разложение ЛВ при 20°С (или другой заданной температуре). Если процесс представляет собой химическую реакцию первого порядка, то расчет ведут по уравнению
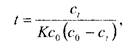
где со — концентрация реагирующего вещества; с1 — концентрация этого вещества, прореагировавшего к моменту времени t
2.9 Пути повышения стабильности лекарственных средств
Методы стабилизации можно разделить на три группы: физические, химические и антимикробные. Они нередко дополняют друг друга.
Методы физической стабилизации. Эти методы основаны на изолировании ЛВ от влияния на их стабильность внешних факторов. Методы используют для замедления химических процессов, происходящих при разложении ЛВ (гидролиза, окисления-восстановления, изомеризации и др.), а также для предотвращения микробного загрязнения ЛС. Так, замедление реакции гидролиза ЛВ можно достигнуть максимальным снижением влажности. Это позволяет нередко увеличивать срок годности в десятки раз.
Существуют различные способы максимального обезвоживания ЛС. Наиболее широко используют ампулирование или герметизацию во флаконах предварительно обезвоженных и простерилизованных ЛВ или ЛФ. Их растворяют непосредственно перед применением. Довольно часто используют неводные растворители (пропиленгликоль, полиэтиленгликоль и др.) для приготовления стабилизированных ЛФ.
Можно повышать стабильность ЛВ, совершенствуя технологический режим процесса получения, повышая степень чистоты исходных и промежуточных продуктов. Существуют и другие пути повышения стабильности ЛФ в условиях промышленного производства. Это приготовление и ампулирование ЛС в токе инертных газов, получение жидких ЛФ в виде лиофилизированных порошков, приготовление сухих суспензий и эмульсий, применение новых способов стерилизации, подбор основ, растворителей, эмульгаторов, консервантов, антноксидантов и других вспомогательных веществ, обеспечивающих высокую стабильность, использование одноразовых герметических упаковок. Повышает до 2 лет сроки хранения использование различных ЛВ в составе глазных пленок. Растворы в шприц-тюбиках или тюбиках-капельницах имеют срок хранения 1-3 года.
На ЛВ, содержащиеся в таблетках, оказывают влияние не только внешние факторы (температура, влага, ультрафиолетовое облучение и т.д.), но и наполнители, вспомогательные вещества, гранулирующие жидкости, тип грануляции, технология изготовления таблеток. Вспомогательные вещества могут вступать с ЛВ в различные физические и химические взаимодействия, выступать в роли катализатора и т.д. Из физических процессов наиболее часто в таблетках может происходить явление адсорбции ЛВ такими наполнителями, как крахмал, производные метилцеллюлозы и др. Для физической стабилизации таблеток используется применение различного рода покрытий, защищающих Л В от воздействия внешних факторов, а также от микробной загрязненности.
Если процесс представляет собой реакцию второго порядка и реагирующие вещества взяты в эквивалентных количествах, то время хранения рассчитывают по уравнению
Важной характеристикой, определяющей защитные свойства упаковочных материалов, является светопроницаемость. Особенно большое значение имеет проницаемость упаковки для УФ-лучей, которые интенсифицируют процессы деструкции самих ЛВ и могут вызывать деструктивные изменения в полимерных материалах. Они воздействуют на карбонильные и ароматические циклы, входящие в структуру полимеров, и приводят к образованию продуктов распада карбонильного. гидроксильного и пероксидного типа, способных вызвать усиление поглощения УФ-лучей.
Методы химической стабилизации.
Основана на введении в лекарственную форму веществ, предотвращающих или замедляющих химические процессы (гидролиз, окисление, каталитическое влияние примесей), приводящие к разложению лекарственных препаратов. Разработка конкретных путей стабилизации возможна после исследования кинетики процессов, происходящих в лекарственных веществах и лекарственных формах под влиянием различных факторов Подбор необходимого стабилизатора осуществляют эмпирически, поскольку механизм процессов, происходящих под действием стабилизаторов, не всегда исследован. При этом учитывают, что процессы разложения лекарственных веществ зависят как от их химической структуры, так и от влияния различных внешних факторов. В качестве стабилизаторов используют вещества различной химической природы, причём некоторые из них являются лекарственными средствами.
Стабилизаторами могут быть неорганические вещества: кальция хлорид, калия фосфат однозамещенный; органические вещества: ацетат натрия, этанол, глицерин, поливиниловый спирт, этиленгликоль, лактоза, глюкоза, мочевина, тиомочевина, метионин, цистеин, лимонная кислота, аскорбино-вая кислота. Весьма эффективными стабилизаторами являются органические вещества гетероциклической структуры: поливинилпирролидон, антипирин, анальгин, изониазид, никотиновая кислота, изоникотиновая кислота, кофеин.
По механизму стабилизирующего действия все стабилизаторы можно разделить на несколько групп: антиоксиданты, комплексообразователи, клатратообразователи, другие стабилизаторы.
Антиоксиданты, являясь сильными восстановителями, обладают более высокой реакционной активностью по отношению к кислороду, чем лекарственные вещества. Окисляясь сами, антиоксиданты предохраняют лекарства от окисления. В качестве антиоксидантов используют натрия гидросульфат, ромалит, аскорбиновую кислоту, тиомочевину и др.
Механизм стабилизирующего действия различных антиоксидантов весьма сложен и не во всех случаях одинаков, что обусловлено не только природой антиоксидантов и лекарственных веществ, но и наличием в растворах микропримесей тяжёлых металлов, действием света и тепла, содержанием кислорода и др.
В фармацевтической практике ингибиторы, прерывающие цепную реакцию, не применяются, так как они эффективны только при отсутствии кислорода. Как правило, используются антиоксиданты, замедляющие окисление, препятствующие образованию активных радикалов из гидропероксидов. К наиболее эффективным средствам этой группы относятся фенолы, аминофенолы, анилин и др., они реагируют с пероксидными радикалами по реакции:
RO2 + InH → ROOH + In,
где InH – антиоксидант с подвижным атомом водорода;
In – малоактивный радикал антиоксиданта.
Эффективными антиоксидантами являются вещества, разрушающие гидропероксиды. Они не останавливают процесс окисления, но, снижая скорость разветвления цепей, замедляют окислительный процесс. Это соли кислоты сернистой, а также органические соединения серы. Реакция проте-кает по следующей схеме:
ROOH + R∙SR∙→ ROH + R2 ∙SO
ROOH + R2 ∙SO→ OH + R2 ∙SO2
Стабилизирующее действие некоторых антиоксидантов заключается в том, что они обладают большей интенсивностью окислительно-восстановительных процессов (низкий редокс-потенциал) и поэтому окисляются быстрее, чем лекарственные вещества, связывая кислород в растворе и в воздушном пространстве над ним. В качестве антиоксидантов для стабилизации легкоокисляющихся веществ могут использоваться вещества с более низкими редокс-потен-циалами. Например, редокс-потенциал натрия сульфита равен 0,19, а кислоты аскорбиновой – 0,34. Поэтому натрия ульфит может использоваться для стабилизации кислоты аскорбиновой, а последняя сама может использоваться как антиоксидант для веществ с меньшей способностью к окислению.
Известно, что окислительно-восстановительные процессы усиливаются под влиянием ряда таких факторов, как присутствие ионов тяжёлых металлов, значение pH, количество кислорода, температура и др.
Большое влияние на процесс окисления лекарственных веществ оказывает присутствие следов тяжёлых металлов (Fe3+, Cu2+, Mn2+ и др.), которые являются катализаторами процессов окисления. Ионы тяжёлых металлов, участвуя в цепной окислительно-восстановительной реакции, способны отрывать электроны от присутствующих вместе с ними в растворах различных ионов, переводя последние в радикалы:
Cu 2+ + RCOO− → Cu+ + RCOO∙
Cu2+ + ROOH→ R∙
Образовавшийся радикал может реагировать с кислородом с образованием пероксидного радикала, который далее будет участвовать в цепной реакции по разобранной ранее схеме. Частично восстановленный при этом ион тяжёлого металла может легко окисляться кислородом в первоначальную форму, после чего процесс повторяется:
Cu2+ + [О2] → Cu +
Для получения стабильных растворов легко окисляющихся веществ необходимо избавиться от следов ионов тяжёлых металлов. Для этого используют комплексоны: ЭДТА – этилендиаминтетрауксусная кислота, трилон Б – динатриевая соль этилендиаминтетрауксусной кислоты. Общим свойством комплексонов является способность образовывать прочные внутрикомплексные водорастворимые соединения с большим числом катионов, в том числе и тяжёлых металлов.
Механизм стабилизирующего действия комплексонов связан с переводом имеющихся в растворе лекарственных веществ следов катионов тяжёлых металлов, способных катализировать окислительные процессы, в комплексные, практически недиссоциируемые соединения, неактивные по отношению к идроперекиси.
Комплексоны являются косвенными антиоксидантами. Скорость реакции окисления в значительной степени зависит от значения pH раствора, поскольку ионы гидроксила могут оказывать каталитическое действие на процесс окисления. Это объясняется тем, что ион гидроксила под влиянием следов тяжёлых металлов может превращаться в радикал, который затем участвует в цепной реакции окисления:
Cu2+ + HO − → Cu+ + HO∙
HO∙ + RH → H2 O + R∙
R∙ + O2 → R−O−O∙
H2 O→ OH− + H+
Поэтому для замедления процессов окисления во многие растворы легко окисляющихся веществ (для создания оптимальных границ pH) добавляют кислоту хлороводородную или буферные смеси. Например, к раствору викасола, кроме антиоксиданта, добавляют кислоту хлороводородную; к рас- творам аминозина – кислоту аскорбиновую, которая является одновременно и антиоксидантом, и создаёт необходимые значения pH.
Для стабилизации легкоокисляющихся веществ предложено использовать ВМС. В среде этих веществ замедляется окисление и другие реакции. Объясняется это проникновением низкомолекулярных лекарственных веществ внутрь молекул высокополимера, что обусловливает уменьшение их реакционной способности. Комплексообразователи – это различные химические вещества, которые связывают примеси ионов металлов, катализирующих окислительно-восстановительные реакции. Образующиеся комплексы практически не диссоциируют на ионы. В качестве комплексообразователей наиболее часто применяют производные этилендиаминтетрауксусной кислоты, дигидроксиэтилглицин, инозитфосфорную, лимонную и винную кислоты. С их помощью стабилизируют растворы производных салициловой кислоты, фенотиазина, кислоты изоникотиновой, адреналина, глюкозы, некоторых антибиотиков, витаминов, рентгеноконтрастных и других лекарственных препаратов.
Клатратообразователи образуют соединения включения вследствие внедрения молекул одного вещества в полости, имеющиеся в кристаллической решётке другого вещества. Для выполнения функции «хозяина» наиболее пригодны мочевина, тиомочевина, циклодекстрины, холевые кислоты, оксифлавоны, целлюлоза и другие вещества, внутренний диаметр молекул у которых 5−10 нм и более. Наиболее перспек-тивны такие клатратообразователи, как циклодекстрины, представляющие собой продукты ферментного расщепления крахмала.
Антимикробная стабилизация. Важная роль в пролонгировании сроков годности лекарств принадлежит антимикробной стабильности. Ряд ЛВ и особенно Л Ф служат хорошей средой для развития микроорганизмов, среди которых могут быть не только сапрофита, но и патогенные микроорганизмы. Микробному загрязнению способствуют вспомогательные вещества (крахмал, сахара и др.). В общей номенклатуре Л С около 82% выпускаются для неинъекционного введения, в том числе 65% из них для приема внутрь. Они не стерилизуются, не имеют фармакопейных требований по стерильности и готовятся в условиях, не гарантирующих микробиологическую чистоту. Микроорганизмы, в том числе и патогенные, могут быть внесены в ЛС с сырьем, технологической водой, во время фасовки, упаковки, перевозки, при хранении, применении и т.д.
Проблема микробной загрязненности возникла после того, как в целом ряде стран в результате перорального приема ЛС появились случаи лекарственной инфекции у больных, в том числе сальмонеллезом. Были также обнаружены в ЛВ ряд энтеробактерий, стафилококков, споровых палочек, дрожжевых и плесневых грибов, причем число микроорганизмов в 1 г (I мл) достигало нескольких десятков миллионов. Поэтому ВОЗ и Международная федерация фармацевтов (МФФ) установили нормы, ограничивающие микробную загрязненность нестерильных готовых ЛС. Разработаны схемы и методы определения микробной загрязненности ЛС. Эти нормы и методы включены в фармакопеи большинства стран мира, в т.ч. в ГФ XI (в. 2, с. 193). Периодически в них вносятся изменения.
Развитие микрофлоры можно приостановить с помощью консервантов — веществ, оказывающих бактериостатическое и бактерицидное действие. В качестве консервантов используют неорганические соединения (борную кислоту, соли тяжелых металлов, пероксид водорода), органические соединения (фенолы, этиловый спирт, бензойную кислоту и др.). Пользуясь консервантами, всегда следует иметь в виду, что некоторые из них являются токсическими веществами или обладают аллергическим, канцерогенным, мутагенным действием. Поэтому следует строго контролировать концентрацию консервантов в ЛС.
Date: 2015-09-17; view: 11203; Нарушение авторских прав