
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электрические явления в возбудимых клетках
|
|
Мембранный потенциал покоя. Мембранным потенциалом покоя (МПП) или потенциалом покоя (ПП) называют разность потенциалов покоящейся клетки между внутренней и наружной сторонами мембраны. Внутренняя сторона мембраны клетки заряжена отрицательно по отношению к наружной. Принимая потенциал наружного раствора за нуль, МПП записывают со знаком "минус". Величина МПП зависит от вида ткани и варьирует от -9 до -100 мв. Следовательно, в состоянии покоя клеточная мембрана поляризована. Уменьшение величины МПП называют деполяризацией, увеличение — гиперполяризацией, восстановление исходного значения МПП — ре-поляризацией мембраны.
Основные положения мембранной теории происхождения МПП сводятся к следующему. В состоянии покоя клеточная мембрана хорошо проницаема для ионов К+ (в ряде клеток и для СГ), менее проницаема для Na+ и практически непроницаема для внутриклеточных белков и других органических ионов. Ионы К+ диффундируют из клетки по концентрационному градиенту, а непроникающие анионы остаются в цитоплазме, обеспечивая появление разности потенциалов через мембрану.
Возникающая разность потенциалов препятствует выходу К+ из клетки и при некотором ее значении наступает равновесие между выходом К+ по концентрационному градиенту и входом этих катионов по возникшему электрическому градиенту. Мембранный потенциал, при котором достигается это равновесие, называется равновесным потенциалом. Его величина может быть рассчитана из уравнения Нернста:

где Ек — равновесный потенциал для К +; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; п — валентность К+ (+1), [Кн+] — [К+вн] — наружная и внутренняя концентрации К+-
Если перейти от натуральных логарифмов к десятичным и подставить в уравнение числовые значения констант, то уравнение примет вид:
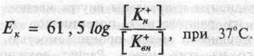
В спинальных нейронах (табл. 1.1) Ек = -90 мв. Величина МПП, измеренная с помощью микроэлектродов заметно ниже - 70 мв.
Если мембранный потенциал клетки имеет калиевую природу, то, в соответствии с уравнением Нернста, его величина должна линейно снижаться с уменьшением концентрационного градиента этих ионов, например, при повышении концентрации К+ во внеклеточной жидкости. Однако линейная зависимость величины МПП от градиента
47
Таблица 1.1. Концентрация некоторых ионов внутри и снаружи спинальных мотонейронов млекопитающих
| Ион | Концентрация | (ммоль/л Н2О) | Разновесный потенциал (мв) |
| внутри клетки | снаружи клетки | ||
| Na+ | 15,0 | 150,0 +60 | |
| К+ | 150,0 | 5,5 -90 | |
| Сl | 9,0 | 125,0 -70 | |
| Мембранный потенциал покоя = -70 мв |
концентрации К+ существует только при концентрации К+ во внеклеточной жидкости выше 20 мМ. При меньших концентрациях К+ снаружи клетки кривая зависимости Ем от логарифма отношения концентрации калия снаружи и внутри клетки отличается от теоретической. Объяснить установленные отклонения экспериментальной зависимости величины МПП и градиента концентрации К+ теоретически рассчитанной по уравнению Нернста можно, допустив, что МПП возбудимых клеток определяется не только калиевым, но и натриевым, и хлорным равновесным потенциалами. Рассуждая аналогично с предыдущим, можно записать:
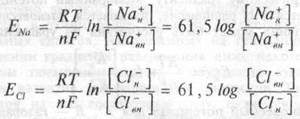
|
Величины натриевого и хлорного равновесных потенциалов для спинальных нейронов (табл. 1.1) равны соответственно +60 и -70 мв. Значение ЕCl равно величине МПП. Это свидетельствует о пассивном распределении ионов хлора через мембрану в соответстии с химическим и электрическим градиентами. Для ионов натрия химический и электрический градиенты направлены внутрь клетки.
Вклад каждого из равновесных потенциалов в величину МПП определяется соотношением между проницаемостью клеточной мембраны для каждого из этих ионов. Расчет величины мембранного потенциала производится с помощью уравнения Гольдмана:
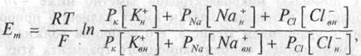
|
где
Еm — мембранный потенциал; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; РK, PNa и РCl — кон-
44
станты проницаемости мембраны для К+ Na+ и Сl, соответственно; [К+н], [K+вн, [Na +н [Na + вн], [Сl-н] и[Сl-вн ]- концентрации K+, Na+ и СГ снаружи (н) и внутри (вн) клетки.
Подставляя в это уравнение полученные в экспериментальных исследованиях концентрации ионов и величину МПП, можно показать, что для гигантского аксона кальмара должно быть следующее соотношение констант проницаемости Рк: PNa: РС1 = I: 0,04: 0,45. Очевидно, что, поскольку мембрана проницаема для ионов натрия (РNa =/ 0) и равновесный потенциал для этих ионов имеет знак "плюс", то вход последних внутрь клетки по химическому и электрическому градиентам будет уменьшать электроотрицательность цитоплазмы, т.е. увеличивать МПП.
При повышении концентрации ионов калия в наружном растворе выше 15 мМ МПП увеличивается и соотношение констант проницаемости меняется в сторону более значительного превышения" Рк над PNa и РС1. Рк: PNa: РС1 = 1: 0.025: 0,4. В таких условиях МПП определяется почти исключительно градиентом ионов калия, поэтому экспериментальная и теоретическая зависимости величины МПП от логарифма отношения концентраций калия снаружи и внутри клетки начинают совпадать.
Таким образом, наличие стационарной разности потенциалов между цитоплазмой и наружной средой в покоящейся клетке обусловлено существующими концентрационными градиентами для К+, Na+ и Сl и различной проницаемостью мембраны для этих ионов. Основную роль в генерации МПП играет диффузия ионов калия из клетки в наружный наствор. Наряду с этим, МПП определяется также натриевым и хлорным равновесными потенциалами и вклад каждого из них определяется отношениями между проницаемостями плазматической мембраны клетки для данных ионов.
Все факторы, перечисленные выше, составляют так называемую ионную компоненту МПП. Поскольку, ни калиевый, ни натриевый равновесные потенциалы не равны МПП. клетка должна поглощать Na+ и терять К+. Постоянство концентраций этих ионов в клетке поддерживается за счет работы Na+ К+-АТФазы.
Однако роль этого ионного насоса не ограничивается поддержанием градиентов натрия и калия. Известно, что натриевый насос электрогенен и при его функционировании возникает чистый поток положительных зарядов из клетки во внеклеточную жидкость, обуславливающий увеличение электроотрицательности цитоплазмы по отношению к среде. Электрогенность натриевого насоса была выявлена в опытах на гигантских нейронах моллюска. Электрофорети-ческая инъекция ионов Na+ в тело одиночного нейрона вызывала гиперполяризацию мембраны, во время которой МПП был значительно ниже величины калиевого равновесного потенциала. Указанная гиперполяризация ослаблялась при снижении температур раствора, в котором находилась клетка, и подавлялась специфическим ингибитором Na+, К+-АТФазы уабаином.
Из сказанного следует, что МПП может быть разделен на две компоненты — "ионную" и "метаболическую". Первая компонента
49
зависит от концентрационных градиентов ионов и мембранных про-ницаемостей для них. Вторая, "метаболическая", обусловлена активным транспортом натрия и калия и оказывает двоякое влияние на МПП. С одной стороны, натриевый насос поддерживает концентрационные градиенты между цитоплазмой и внешней средой. С другой, будучи электрогенным, натриевый насос оказывает прямое влияние на МПП. Вклад его в величину МПП зависит от плотности "насосного" тока (ток на единицу плошади поверхности мембраны клетки) и сопротивления мембраны.
Мембранный потенциал действия. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то МПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной. Это кратковременное изменение МПП, происходящее при возбуждении клетки, которое на экране осциллографа имеет форму одиночного пика, называется мембранным потенциалом действия (МПД).
МПД в нервной и мышечной тканях возникает при снижении абсолютной величины МПП (деполяризации мембраны) до некоторого критического значения, называемого порогом генерации МПД. В гигантских нервных волокнах кальмара МПД равен - 60 мВ. При деполяризации мембраны до -45 мВ (порог генерации МПД) возникает МПД (рис. 1.15).

|
Рис. 1.15 Потенциал
действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
Во время возникновения МПД в аксоне кальмара сопротивление мембраны уменьшается в 25 раз, с 1000 до 40 Ом.см2, тогда как электрическая емкость не изменяется. Указанное снижение сопротивления мембраны обусловлено увеличением ионной проницаемости мембраны при возбуждении.
По своей амплитуде (100-120 мВ) МПД на 20-50 мВ превышает величину МПП. Другими словами, внутренняя сторона мембраны на короткое время становится заряженной положительно по отношению к наружной, — "овершут" или реверсия заряда.
Из уравнения Гольдмана следует, что лишь увеличение проницаемости мембраны для ионов натрия может привести к таким изменениям мебранного потенциала. Значение Ек всегда меньше, чем величина МПП, поэтому повышение проницаемости мембраны для К+ будет увеличивать абсолютное значение МПП. Натриевый равновесный потенциал имеет знак "плюс", поэтому резкое увеличение проницаемости мембраны для этих катионов приводит к перезарядке мембраны.
Во время МПД увеличивается проницаемость мембраны для ионов натрия. Расчеты показали, что если в состоянии покоя соотношение констант проницаемости мембраны для К+, Na+ и СГ равно 1:0,04:0,45, то при МПД - Рк: PNa: Р = 1: 20: 0,45. Следовательно, в состоянии возбуждения мембрана нервного волокна не просто утрачивает свою избирательную ионную проницаемость, а, напротив, из избирательно проницаемой в покое для ионов калия она становится избирательно проницаемой для ионов натрия. Увеличение натриевой проницаемости мембраны связано с открыванием потенциал-зависимых натриевых каналов.
Механизм, который обеспечивает открывание и закрывание ионных каналов, получил название ворот канала. Принято различать активационные (m) и инактивационные (h) ворота. Ионный канал может находиться в трех основных состояниях: закрытом (m-ворота закрыты; h-открыты), открытом (m- и h-ворота открыты) и инак-тивированном (m-ворота открыты, h- ворота закрыты) (рис 1.16).

Рис. 1.16 Схема положения активационных (m) и инактивационных (h) ворот натриевых каналов, соответствующие закрытому (покой, А), открытому (активация, Б) и инактивированному (В) состояниям.
Деполяризация мембраны, вызываемая раздражающим стимулом, например, электрическим током, открывает m-ворота натриевых каналов (переход из состояния А в Б) и обеспечивает появление направленного внутрь потока положительных зарядов — ионов на-
5/
трия. Это ведет к дальнейшей деполяризации мембраны, что, в свою очередь, увеличивает число открытых натриевых каналов и, следовательно, повышает натриевую проницаемость мембраны. Возникает "регенеративная" деполяризация мембраны, в результате которой потенциал внутренней стороны мембраны стремится достичь величины натриевого равновесного потенциала.
Причиной прекращения роста МПД и реполяризации мембраны клетки является: а) увеличение деполяризации мембраны, т.е. когда Ем -» ENa, в результате чего снижается электрохимический градиент для ионов натрия, равный Ем —> ENa. Другими словами, уменьшается сила, "толкающая" натрий внутрь клетки; б) деполяризация мембраны порождает процесс инактивации натриевых каналов (закрывание h-ворот; состояние В канала), который тормозит рост натриевой проницаемости мембраны и ведет к ее снижению; в) деполяризация мембраны увеличивает ее проницаемость для ионов калия. Выходящий калиевый ток стремится сместить мембранный потенциал в сторону калиевого равновесного потенциала.
Снижение электрохимического потенциала для ионов натрия и инактивация натриевых каналов уменьшает величину входящего натриевого тока. В определенный момент времени величина входящего тока натрия сравнивается с возросшим выходящим током — рост МПД прекращается. Когда суммарный выходящий ток превышает входящий, начинается реполяризация мембраны, которая также имеет регенеративный характер. Начавшаяся реполяризация ведет к закрыванию активационных ворот (m), что уменьшает натриевую проницаемость мембраны, ускоряет реполяризацию, а последняя увеличивает число закрытых каналов и т.д.
Фаза реполяризации МПД в некоторых клетках (например, в кар-диомиоцитах и ряде гладкомышечных клеток) может замедляться, формируя плато ПД, обусловленное сложными изменениями во времени входящих и выходящих токов через мембрану. В последействии МПД может возникнуть гиперполяризация или/и деполяризация мембраны. Это так называемые следовые потенциалы. Следовая гиперполяризация имеет двоякую природу: ионную и метаболическую. Первая связана с тем, что калиевая проницаемость в нервном волокне мембраны остается некоторое время (десятки и даже сотни миллисекунд) повышенной после генерации МПД и смещает мембранный потенциал в сторону калиевого равновесного потенциала. Следовая гиперполяризация после ритмической стимуляции клеток связана преимущественно с активацией электрогенного натриевого насоса, вследствие накопления ионов натрия в клетке.
Причиной деполяризации, развивающейся после генерации МПД, является накопление ионов калия у наружной поверхности мембраны. Последнее, как это следует из уравнения Гольдмана, ведет к увеличению МПП.
С инактивацией натриевых каналов связано важное свойство нервного волокна, называемое рефрактерностью. Во время абсолютного рефрактерного периода нервное волокно полностью утрачивает способность возбуждаться при действии раздражителя любой
52
силы. Относительная рефрактерность, следующая за абсолютной, характеризуется более высоким порогом возникновения МПД.
Представление о мембранных процессах, происходящих во время возбуждения нервного волокна, служит базой для понимания и явления аккомодации. В основе аккомодации ткани при малой крутизне нарастания раздражающего тока лежит повышение порога возбуждения, опережающее медленную деполяризацию мембраны. Повышение порога возбуждения почти целиком определяется инактивацией натриевых каналов. Роль повышения калиевой проницаемости мембраны в развитии аккомодации состоит в том, что оно приводит к падению сопротивления мембраны. Вследствие снижения сопротивления скорость деполяризации мембраны становится еще медленнее. Скорость аккомодации тем выше, чем большее число натриевых каналов при потенциале покоя находится в инактивиро-ванном состоянии, чем выше скорость развития инактивации и чем выше калиевая проницаемость мембраны.
Проведение возбуждения. Проведение возбуждения по нервному волокну осуществляется за счет локальных токов между возбужденным и покоящимися участками мембраны. Последовательность событий в этом случае представляется в следующем виде.
При нанесении точечного раздражения на нервное волокно в соответствующем участке мембраны возникает потенциал действия. Внутренняя сторона мембраны в данной точке оказывается заряженной положительно по отношению к соседней, покоящейся. Между точками волокна, имеющими различный потенциал, возникает ток (локальный ток), направленный от возбужденного (знак (+) на внутренней стороне мембраны) к невозбужденному (знак (-) на внутренней стороне мембраны) к участку волокна. Этот ток оказывает деполяризующее влияние на мембрану волокна в покоящемся участке и при достижении критического уровня деполяризации мембраны в данном участке возникает МПД. Этот процесс последовательно распространяется по всем участкам нервного волокна.
В некоторых клетках (нейронах, гладких мышцах) МПД имеет не натриевую природу, а обусловлен входом ионов Ca2+ по потенциал-зависимым кальциевым каналам. В кардиомиоцитах генерация МПД связана с входящими натриевым и натрий-кальциевым токами.
1.9. Трансэпителиальный транспорт
В некоторых органах (желудок, кишечник, желчный пузырь, почки, легкие) транспорт веществ осушествляется через слой клеток, а не единичную клеточную мембрану. Такой перенос веществ называют трансэпителиальным.
Перенос органических веществ, Сахаров, аминокислот через эпителиальный барьер происходит по механизму сопряженного с ионами натрия транспорта, то есть этот транспорт осуществляется со значительной скоростью лишь в присутствии ионов натрия. В мембране эпителиоцита, обращенной в просвет органа, образуется ком-
53
плекс субстрат-переносчик-Na+. За счет энергии электрохимического градиента ионов натрия комплекс перемещается на внутреннюю, цитоплазматическую сторону апикальной мембраны, где и распадается с освобождением в цитоплазму субстрата и натрия. Благоприятный для входа ионов натрия концентрационный градиент создается за счет работы Na+, К+-АТФазы, локализованной в базальной, обращенной к серозе, мембране эпителиоцита. Следовательно, транспорт Сахаров и аминокислот в эпителиоцит против их концентрационного градиента осуществляется за счет вторичного активного транспорта. Из цитоплазмы эпителиальных клеток сахара и аминокислоты диффундируют в серозную часть органа через базальную мембрану по градиенту их концентрации, вероятно, с участием еще одного, но уже натрий-независимого переносчика (рис. 1.17).
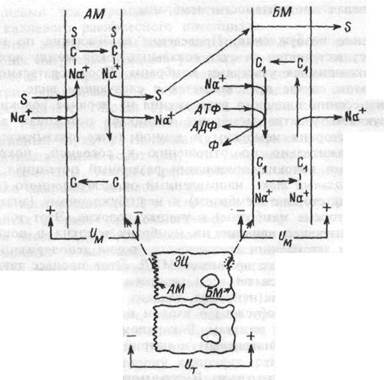
Рис. 1.17 Схема сопряжения транспорта Сахаров и аминокислот с транспортом натрия в эпителии тонкой кишки.
ЭЦ, AM, БМ — эпителиоцит, его апикальная и базальная мембраны;
S—С—Na+ — тройной комплекс: S — сахар или аминокислота, С — переносчик, С1 — Na+, К+ — АТФаза (или переносчик натрия через базапьную мембрану);
И м Ит — трансмембранная и трансэпителиальная разность потенциалов
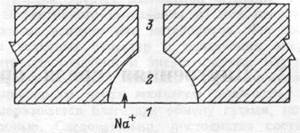
Рис. 1.18 Модель, поясняющая возможные механизмы противоградиентного транспорта воды.
Перенос сопи через мембрану (I) приводит к повышению её концентрации в замкнутом объёме (2), расположенном в межклеточном пространстве. Канал (3), через который вода и растворенные в ней вещества по градиенту гидростатического давления выводятся в соединительную ткань.
В результате активного транспорта ионов натрия создается трансэпителиальная разность потенциалов со знаком "плюс" на серозной поверхности эпителия. Этот электрический градиент является источником энергии для транспорта ионов хлора и других анионов из просвета органа в кровь.
Работа натриевого насоса, обеспечивая активное выведение ионов натрия, создает и трансэпителиальный осмотический градиент, в результате чего поток воды направляется из полости органа наружу через монослой клеток. Вода может поступать и против осмотического градиента. Возможные механизмы такого переноса воды рассматриваются на модели (рис. 1.18). Допускается, что межклеточные пространства эпителия представляют собой изолированные со стороны просвета органа полости. В эти полости активно транспортируются ионы натрия; хлор следует за ними пассивно по градиенту электрического потенциала. Создание гипертонической среды (NaCl) в замкнутом пространстве обуславливает возникновение водного потока, направленного в эту же полость. Поступление воды приводит к снижению концентрации NaCl в межклеточном пространстве до изотонической. Однако изотонический раствор, накопление которого продолжается благодаря действию натриевого насоса, вследствие повышения гидростатического давления в полости будет вытесняться в соединительную ткань, прилегающую к стенке органа.
Детали работы описанного механизма в разных органах и организмах могут быть различными. Так, в эпителии кишечника предполагается существование активного транспорта не только натрия и калия, но и хлора. Интенсивно изучается роль Сl-/НСО3- — обмен-ника в процессах всасывания.
Date: 2015-09-19; view: 517; Нарушение авторских прав