
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение скелетной мышцы
|
|
Скелетная мышца состоит из группы мышечных пучков, каждый из которых состоит из тысяч отдельных мышечных клеток (волокон) (рис. 2А). Каждое волокно скелетной мышцы – это тонкое (диаметром от 10 до 100 мкм), вытянутое на значительную длину многоядерное образование – симпласт. Количество мышечных волокон окончательно устанавливается через 4 – 5 месяцев после рождения и затем практически не меняется, зато их диаметр может значительно увеличиваться под воздействием тренировки.
Мышечное волокно скелетной мышцы представляет собой клетку цилиндрической формы, длина которого определяется размером мышцы и может составлять от нескольких миллиметров до нескольких сантиметров. В мышце с параллельным ходом волокон они обычно крепятся к обоим сухожилиям, но в очень длинных мышцах (например, портняжной) большое число волокон короче всей мышцы. Такие мышечные волокна крепятся одним концом к сухожилию, а другим – к соединительнотканным перемычкам внутри мышцы.
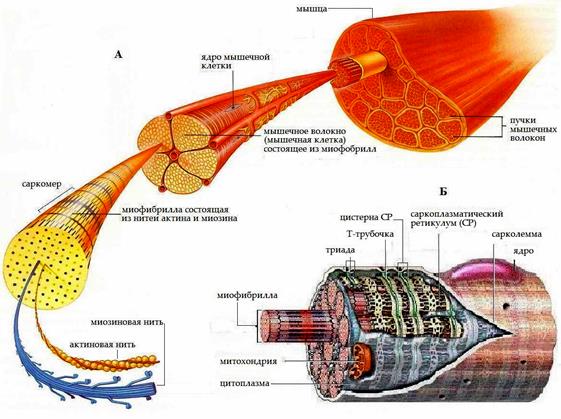
Рис 2. Строение скелетной мышцы (А) и её клетки (Б)
Как и всякая клетка, мышечная – имеет все основные клеточные элементы (Рис. 2 Б) – плазматическую мембрану, цитоплазму, клеточные органоиды. Среди особенностей следует отметить наличие большого числа митохондрий, обеспечивающих огромные энергетические потребности мышечной клетки, и многоядерность. Мышечные клетки не делятся, только растут, формируя мощный сократительный аппарат образованный специализированными белками, и одно ядро не в состоянии обеспечить активные процессы биосинтеза белка, идущие в клетке.
Снаружи мышечное волокно покрыто тонкой эластичной мембраной – сарколеммой. Сарколемма возбудима, её структура подобна структуре мембран нервных клеток. Мембрана мышечного волокна имеет регулярные впячивания внутрь клетки, образуя так называемые поперечные трубочки – Т-образные трубки диаметром 50 нм. Т- система пересекает все мышечное волокно и связывает сарколемму с внутриклеточным пространством и, прежде всего, с замкнутой системой мембран саркоплазматического ретикулума.
Саркоплазматический ретикулум – важный элемент саркоплазмы – внутреннего содержимого мышечного волокна. Он имеет прямое отношении к регуляции сократительной активности клетки и представляет собой систему сложно связанных между собой мембранных элементов в виде вытянутых емкостей – продольных трубочек. Продольные трубочки примыкают к поперечным, образуя в зоне контактов так называемые цистерны. Поперечная трубочка с прилегающими к ней с двух сторон цистернами образует характерную структуру - триаду. Ретикулярные триады фиксированы так, что их центр находится вблизи границы А – и I – дисков (см. ниже).
Цистерны являются внутриклеточным хранилищем ионов кальция необходимых для запуска и регуляции мышечного сокращения. Мембрана цистерн возбудима, и благодаря наличию на ней Са2+ каналов и Са2+ насосов (АТФ-аз) способна перемещать ионы кальция из саркоплазмы в цистерну и обратно, регулируя, таким образом, их концентрацию внутри клетки.
Т-система и саркоплазматический ретикулум – это устройства, обеспечивающие функциональное согласование процессов возбуждения клеточной мембраны с активностью сократительного аппарата мышечного волокна.
Сократительный аппарат клетки – это миофибриллы, пучки, расположенных в саркоплазме, длинных белковых нитей, которые тянутся вдоль всего мышечного волокна. Именно с ними связана способность мышцы к сокращению. Миофибриллы состоят из определенным образом собранных толстых и тонких нитей (протофибрилл), образованных сократительными белками:
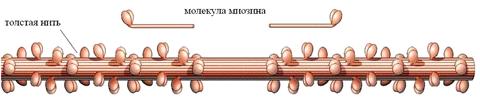 Миозин, основной компонент толстых нитей. Молекула миозина построена из двух больших и четырех малых полипептидных цепей образующих один вытянутый «хвост», имеющий a-спиральную конформацию, и две глобулярные «головки» (Рис. 3).
Миозин, основной компонент толстых нитей. Молекула миозина построена из двух больших и четырех малых полипептидных цепей образующих один вытянутый «хвост», имеющий a-спиральную конформацию, и две глобулярные «головки» (Рис. 3).
Рис. 3. Толстая нить миофибрилл и образующая её молекула миозина.
«Хвосты» миозина формируют основу толстой нити, а «головки» выступающие из неё, образуют расположенные по спирали поперечные мостики. Эти мостики при определенных условиях способны образовывать контакты с расположенными вокруг них тонкими нитями. При этом активируется АТФ-азная способность «головок», за счет которой угол их наклона изменяется и «головки» совершают, так называемые, «гребковые движения», напоминающих движения весел. Головки перемещаются не только сами, но и перемещают тонкие нити, с которыми в этот момент связаны.
Отметим, что молекулы миозина противоположных концов толстой нити расположены навстречу друг другу ««хвостами» (Рис.3), поэтому «гребковые движения» их «головок» совершаются навстречу друг другу. По той же причине, середина толстой нити лишена поперечных мостиков.
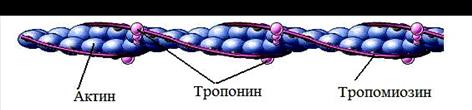 Основной компонент тонких нитей (Рис. 4) – белок актин. Это фибрилярный белок (F-актин), образованный из мономерных глобулярных единиц (G –актин). По своей структуре F-актин похож на две нитки бус, в которых бусинками служат молекулы G-актина; нити закручены друг вокруг друга в спиральную структуру с шагом 36 -38 нм.
Основной компонент тонких нитей (Рис. 4) – белок актин. Это фибрилярный белок (F-актин), образованный из мономерных глобулярных единиц (G –актин). По своей структуре F-актин похож на две нитки бус, в которых бусинками служат молекулы G-актина; нити закручены друг вокруг друга в спиральную структуру с шагом 36 -38 нм.
Рис.4. Тонкая нить миофибрилл, и образующие её белки.
Именно с молекулами G-актина, способны образовывать контакты головки молекул миозина, что и приводит к образованию поперечных мостиков между толстыми и тонкими нитями и именно при этом контакте активируется АТФ-азная активность головок, поэтому, в покое существует преграда, препятствующая этому контакту. Таким препятствием является молекула тропомиозина.
Тропомиозин – еще один компонент тонких нитей. Его молекула представляет собой тяж образованный двумя переплетающимися a-спиральными полипептидными цепями. Тропомиозин связан с F-актином и каждая его молекула прикрывает семь G-актиновых глобул. Соседние молекулы тропомиозина немного перекрываются между собой, так что образуется непрерывная тропомиозиновая цепь, идущая вдоль F-актинового волокна отделяющая его от головок миозина.
Однако контакт между актином и миозином, необходимый для процесса сокращения возможен, благодаря еще одному белку – тропонину.
Тропонин – последний компонент тонких нитей, является комплексом трех белков: тропонина I, тропонина Т и тропонина С. Он имеет в целом более или менее глобулярную форму и располагается на F-актине через правильные промежутки, равные примерно 38 нм. Тропонин связан с тропомиозином и при увеличении внутриклеточной концентрации ионов Са2+ меняет свою конформацию, смещая нить тропомиозина с головок актина. Таким образом, он обеспечивает возможность контакта толстых и тонких нитей.
Миофибриллам свойственна поперечная исчерченность — чередование темных и светлых полос. Границы и периодичность полос в миофибриллах одного волокна совпадают, что создает поперечную исчерченность мышечного волокна, обусловленную строго упорядоченным расположением актиновых и миозиновых филаментов (рис. 5).
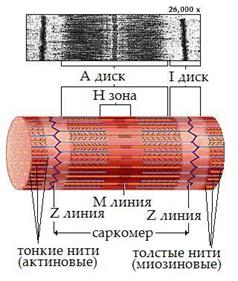 Темные полосы миофибрилл в поляризованном свете проявляют свойства двойного лучепреломления и поэтому называются А-дисками (анизотропными). Это место расположения группы параллельных толстых нитей, которые чередуется с изотропной группой тонких нитей, I – дисками (изотропными). Светлые I-диски делятся пополам поперечной темной Z-линией, с обеих сторон которой крепятся тонкие (актиновые) нити. Участок между двумя соседними Z-линиями называется саркомером (рис. 5). В каждом саркомере имеется два набора тонких нитей, прикрепленных к Z-линиям, и один комплект толстых нитей, сосредоточенных в А-диске. В покоящейся мышце концы толстых и тонких филаментов лишь незначительно перекрываются на границе между А- и I-дисками. В световом микроскопе зона перекрытия в А-диске представляется темнее, чем центральная Н-зона, лишенная актиновых нитей.
Темные полосы миофибрилл в поляризованном свете проявляют свойства двойного лучепреломления и поэтому называются А-дисками (анизотропными). Это место расположения группы параллельных толстых нитей, которые чередуется с изотропной группой тонких нитей, I – дисками (изотропными). Светлые I-диски делятся пополам поперечной темной Z-линией, с обеих сторон которой крепятся тонкие (актиновые) нити. Участок между двумя соседними Z-линиями называется саркомером (рис. 5). В каждом саркомере имеется два набора тонких нитей, прикрепленных к Z-линиям, и один комплект толстых нитей, сосредоточенных в А-диске. В покоящейся мышце концы толстых и тонких филаментов лишь незначительно перекрываются на границе между А- и I-дисками. В световом микроскопе зона перекрытия в А-диске представляется темнее, чем центральная Н-зона, лишенная актиновых нитей.
Саркомер является структурным элементом миофибриллы, которая перактически и состоит из многократно повторяющихся саркомеров. При длине типичного мышечного волокна человека 5 см его миофибриллы насчитывают порядка 20 000 последовательно расположенных саркомеров.
Саркомер является и функциональным элементом миофибриллы. Это сократительный аппарат мышечного волокна, изменение длины (укорочение) которого и происходит в процессе сокращения мышцы.
Сигналом к началу сокращения служит приходящий из ЦНС нервный импульс, который инициирует процесс электро-механического сопряжения.
Рис. 5 Саркомер
Электро-механическое сопряжение – это процесс перевода электрической энергии нервного импульса в механическую энергию сокращающейся (укорачивающейся) мышцы. Он начинается с передачи нервного импульса с нервной клетки на мышечную. Передача возбуждения осуществляется нервно-мышечным синапсом.
Напомним, нервно-мышечный синапс (рис.6), с помощью которого мотонейрон связан с мышечным волокном, имеет две основные части – нервную (пресинаптическую) и мышечную (постсинаптическую).
Пресинаптическая часть представлена концевой веточкой аксона (нервным окончанием), погруженной в углубление на поверхности мышечного волокна. В момент возбуждения мембрана нервного окончания способна пропускать внутрь не только ионы Na+, но и Са2+ через потенциал чувствительные каналы.
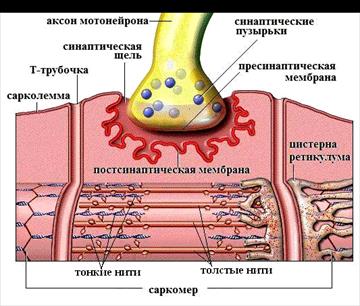 Нервное окончание содержит более миллиона синаптических пузырьков содержащих ацетилхолин (АХ) - медиатор нервно-мышечного синапса. Пресинап-тическая мембрана, непосредственно обращенная к мышечной клетке проницаема для ацетилхолина.
Нервное окончание содержит более миллиона синаптических пузырьков содержащих ацетилхолин (АХ) - медиатор нервно-мышечного синапса. Пресинап-тическая мембрана, непосредственно обращенная к мышечной клетке проницаема для ацетилхолина.
Постсинаптическая мембрана (концевая пластинка) – часть мембраны мышечной клетки. Она образует многочисленные складки, уходящие в глубь волокна, благодаря чему увеличивается ее поверхность. Электроуправляемых каналов на постсинаптической мембране нет, поэтому она не возбудима(т.е. ПД на ней не генерируется), но имеется большое количество хемоуправляемых ионных каналов, активность которых возрастает при взаимодействии их рецептора с ацетилхолином.
Рис. 6. Схема электромеханического
сопряжения (объяснения в тексте) ►
Пре- и постсинаптическая мембраны разделены узкой синаптической щелью, открывающейся во внеклеточное пространство. Внутри щели содержится большое количество фермента ацетилхолинэстераза (АХЭ), разрушающей ацетилхолин.
Проведение возбуждения с нервного волокна на мышечное можно представить схематически следующим образом:
- Когда возбуждение распространяющееся по аксону достигает нервного окончания, внутрь него, через потенциал чувствительные Са2+ -каналы, попадают ионы кальция.
- Под действием кальция, внутри нервного окончания происходит разрушение синаптических пузырьков. Содержащийся в них ацетилхолин высвобождается и через пресинаптическуь мембрану попадает в синаптическую щель.
- Выделившийся ацетилхолин диффундирует через синаптическую щель и вступает в реакцию с имеющимися на постсинаптической мембране мышечного волокна холинорецепторами;
- При образовании комплекса «АХ-рецептор» хемоуправляемые ионные каналы постсинаптической мембраны активируются, ионная проницаемость мембраны концевой пластинки увеличивается.
- Движение ионов натрия через эти каналы приводит к возникновению локального электрического потенциала – потенциала концевой пластинки (ПКП) или возбуждающего постсинаптического потенциала (ВПСП);
- При достижении пороговой величины ВПСП, концентрация ионов натрия возрастает настолько, что это электрически возбуждает соседнюю (внесинаптическую) мембрану мышечного волокна, на которой имеются электроуправляемые ионные каналы.
- Возбуждение электроуправляемых ионных каналов мышечной клетки приводит к генерации на ней распространяющегося потенциала действия (ПД), который вначале возникает вблизи синапса, а затем распространяется по всем направлениям от концевой пластинки, охватывая возбуждением все мышечное волокно;
- Комплекс «АХ-рецептор» быстро разрушается специальным ферментом - ацетилхолинэстеразой, которая, как уже отмечалось, в большой концентрации содержится в области мембраны концевой пластинки. Разрушение комплекса сопровождается восстановлением исходной проницаемости постсинаптической мембраны и затуханием ПКП.
Потенциал действия распространяется не только по поверхностной мембране мышечного волокна, но и по идущим внутрь клетки мембранам, выстилающим поперечные трубочки (Т-трубочки) (рис.6). Распространение волны деполяризации по поперечным трубочкам вызывает деполяризацию мембран цистерн продольных трубочек саркоплазматического ретикулума. Эта деполяризация приводит к выходу ионов кальция из цистерн, через быстрые потенциалчувствительные Са2+ -каналы их мембран в межфибриллярное пространство. Там кальций взаимодействует с сократительными белками, что запускает процесс сокращения мышечного волокна.
Такой процесс является составной частью механизма, с помощью которого осуществляется связь между возбуждением и сокращением мышечного волокна. Этот механизм носит разные названия: связь «возбуждение – сокращение», электромеханическая связь (ЭМС) или электромеханическое сопряжение.
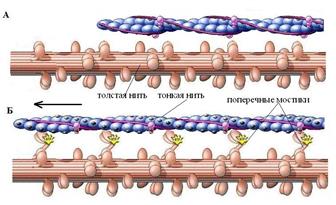 Механизм сокращения мышцы, заключается в перемещении (протягивании) тонких нитей к центру саркомера, вдоль неподвижных толстых за счет «гребных» движений головок миозина. Эта теория получила название теории скользящих нитей.
Механизм сокращения мышцы, заключается в перемещении (протягивании) тонких нитей к центру саркомера, вдоль неподвижных толстых за счет «гребных» движений головок миозина. Эта теория получила название теории скользящих нитей.
Разнообразные исследования привели к следующему представлению о механизме циклической работы поперечного миозинового мостика.
В покое миозиновый мостик фосфорили-рован, но он не может осуществить контакт с нитью актина, так как между ними вклинена система из нити тропомиозина и глобулы тропонина (Рис.7А).
После возбуждения мышечного волокна
| Рис 7. Взаимодействие толстых и тонких нитей в процессе сокращения. | ионы Са2+ из цистерн ретикулума попадают в саркоплазму где взаимодействуют с сократитель- ными белками тонких нитей. В результате тропонин |
изменяет свою конформацию и смещает нить тропомиозина с актиновой цепочки, открывая для миозиновой головки возможность соединения с актином.
Соединение головки миозина с актином, который активирует АТФ-азную активность миозина, приводит к резкому изменению конформации мостиков и перемещению (скольжению) нити актина вдоль нити миозина (Рис 7Б). Эта процедура осуществляется за счет энергии АТФ.
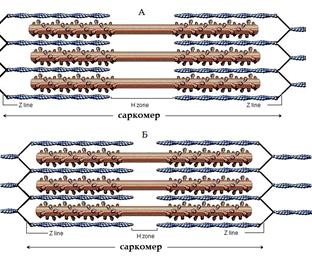 Так как молекулы миозина в противоположных концах толстой нити саркомера ориентированы навстречу друг другу, то скольжение тонких нитей прикрепленных к противоположным концам саркомера так же осуществляется навстречу друг другу. В результате саркомер укорачивается (Рис. 8), мышца сокращается.
Так как молекулы миозина в противоположных концах толстой нити саркомера ориентированы навстречу друг другу, то скольжение тонких нитей прикрепленных к противоположным концам саркомера так же осуществляется навстречу друг другу. В результате саркомер укорачивается (Рис. 8), мышца сокращается.
Расслабление мышцы происходит благодаря работе Са2+ АТФ-аз (насосов), расположенных в мембранах цистерн саркоплпзматического ретикулума. За счет энергии АТФ они закачивают выделившийся кальций обратно в цистерны. Снижение концентрации ионов кальция приводит к отсоединению его от тропонина, и тропомиозин снова блокирует актин. Связь между актиновыми и миозиновыми нитями разрывается, тонкие нити возвращаются в исходное состояние и мышца расслабляется.
| Рис.8. Укорочение саркомера в процессе сокращения. А – расслабленное состояние саркомера; Б – состояние саркомера при сокращении; | Напряжение, развиваемое мышцами при сокращении, реализуется по-разному. |
Date: 2015-09-19; view: 836; Нарушение авторских прав