
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Стандартизация лекарственных средств. Контрольно-разрешительная система обеспечения качества лекарственных средств
|
|
1. Стандартизация ЛС.
На всех этапах создания и использования ЛС контроль его качества осуществляют: отдел технического контроля предприятия-изготовителя (ОТК), заводские лаборатории, контрольно-аналитические лаборатории, в аптеке - провизоры-аналитики.
Государственная система контроля качества ЛС носит название контрольно-разрешительной системы Минздрава России, которая включает две структурные единицы:
· Департамент государственного контроля качества ЛС и медицинской техники (Департамент);
· Управление обеспечения лекарствами и медицинскими изделиями (Управление).
Одна из функций Департамента - регистрация ЛС. Регистрации и перерегистрации подлежат новые ЛС (субстанции, монопрепараты, комплексные препараты); новые комбинации ЛС, зарегистрированных ранее; ЛС, зарегистрированные ранее, но произведенные в новых лекарственных формах, с новой дозировкой или с другим составом вспомогательных веществ; воспроизведенные ЛС ("дженерики") и т.д.
После прохождения будущими ЛС доклинических испытаний составляется проект Фармакопейной статьи. Проект ФС и отчет по доклиническим испытаниям подаются в Департамент. Экспертизу материалов осуществляет созданный при Департаменте Научный центр экспертизы и Государственного контроля качества, в который входит ряд институтов и комитетов.
После экспертизы регистрационных документов Президиум Фармакопейного комитета рекомендует ФС к регистрации, которая осуществляется Департаментом государственного контроля.
После проведения доклинических испытаний и утверждения ФС назначаются клинические испытания ЛС. После их завершения Фармакологический комитет принимает решение об утверждении ЛС.
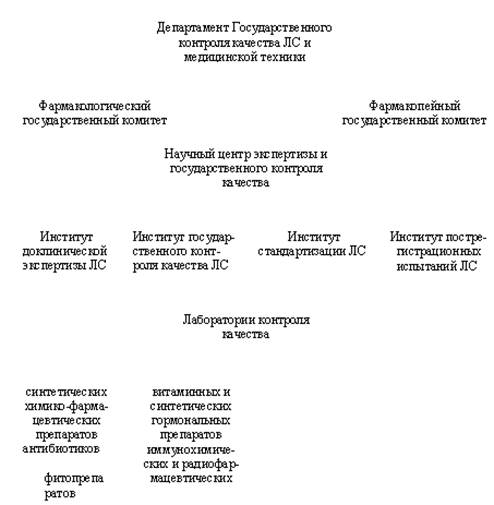
Государственная система контроля качества лекарственных средств
2. Государственный контроль качества.
После регистрации ЛС проходит Государственный контроль качества.
Контроль качества ЛС - установление соответствия качества ЛС утвержденным нормативным документам.
Государственная система контроля качества ЛС устанавливает нормы качества лекарственных и вспомогательных веществ, используемых в производстве лекарственных препаратов, которые включаются в нормативно-техническую документацию - фармакопейная статья, фармакопейная статья предприятия, Государственная Фармакопея, ГОСТы.
Государственный контроль качества ЛС может осуществляться в форме предварительного, а также в виде последующего (выборочного) и арбитражного контроля.
Предварительному контролю подлежат ЛС, которые впервые разрешены к медицинскому применению; впервые выпускаемые данным предприятием; выпускаемые по измененным технологиям; переведенные Департаментом на этот вид контроля (при определенном числе бракованной продукции).
При проведении Государственного контроля в Департамент направляют образцы субстанций и аналитических паспортов качества первых пяти промышленных серий ЛС. Государственный контроль проводит Институт государственного контроля качества ЛС по утвержденным нормативным документам (НД). Институт дает рекомендацию на последующий (выборочный) контроль. Арбитражный контроль проводят при разногласиях по качеству между производителем и покупателем. Это относится как к российским, так и к зарубежным ЛС.
3. Сертификация ЛС.
Сертификации подлежат ЛС серийного производства, выпускаемые предприятиями различных форм собственности, а также ввозимые из-за рубежа.
Сертификация ЛС - это процесс компетентного подтверждения специально аккредитованными органами безопасности и соответствия качества ЛС требованиям нормативного документа.
Сертификация ЛС включает: сертификацию производства (соответствие правилам GMP); сертификацию ЛС.
Центральный орган по сертификации ЛС - это федеральное государственное учреждение - Центр сертификации ЛС Минздрава России. В структурную схему сертификации входят также территориальные органы по сертификации ЛС, контрольные лаборатории.
На территории России введен сертификат соответствия ЛС единого образца, который выдается органом по сертификации сроком на 1 год.
После проверки по показателям "Описание", "Упаковка" и "Маркировка" обязательному контролю по всем показателям подлежит большая группа лекарственных средств и вспомогательных веществ, используемых или изготовляемых в аптеках. Кроме того, полному контролю подлежат психотропные средства (субстанции и лекарственные формы); Л С для наркоза, в том числе инъекционные, за исключением кислорода и закиси азота (оксида азота (1) N2О); все лекарственные формы для детей; препараты инсулина; рентгеноконтрастные средства.
Информация о случаях выявления брака сообщается на предприятие-производитель, поставщику и в Департамент.
Date: 2015-09-18; view: 986; Нарушение авторских прав