
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакции комплексообразования и их применение в анализе
|
|
Общие сведения. Вначале реакции комплексообразования нашли свое применение в качественном анализе – образование или разрушение окрашенных комплексов позволяет обнаружить многие вещества, в частности, катионы переходных металлов (см. раздел 4.1). Позднее некоторые из этих реакций стали использовать и для количественного анализа: малорастворимые комплексные соединения могут быть осаждаемой и даже гравиметрической формой (раздел 4.2). Реакции образования комплексных соединений – основа метода комплексометрии, широко распространенного в практике титриметрического анализа (раздел 4.5). В фотометрическом анализе определяемые вещества переводят в поглощающие свет комплексы, а уже затем измеряют аналитический сигнал (раздел 6.3). Аналогичные реакции позволяют проводить экстракционное разделение и концентрирование микропримесей (раздел 7.2). Наконец, с помощью реакций комплексообразования можно целенаправленно регулировать кислотно-основные или окислительно-восстановительные свойства определяемых веществ.
Строение и состав комплексных соединений впервые были объяснены в рамках координационной теории А. Вернера на рубеже XIX и XX веков. Напомним, что любой комплекс должен включать центральный атом (комплексообразователь) и лиганды (молекулы или анионы). Они связаны ковалентными связями, образованными по донорно-акцепторному механизму. Получающуюся при таком взаимодействии устойчивую заряженную частицу можно рассматривать как внутреннюю сферу комплексного соединения, с которой слабо связаны ионы внешней сферы. Последние имеют заряд, противоположный заряду внутренней сферы, и удерживаются около нее ионными связями. Из раствора кристаллизуются именно такие – нейтральные – комплексные соединения. Примеры – К4[Fe(CN)6] или [Cu(NH3)4]Cl2. Свойства выделенных из раствора нейтральных комплексных соединений изучают специалисты в области неорганической и координационной химии.
Несколько по-другому подходят к комплексообразованию аналитики. Они изучают и применяют реакции между комплексообразователем и лигандами, идущие в растворе. В водном растворе «внутренняя сфера» является самостоятельной частицей, ионы внешней сферы связаны с ней очень слабо, практически не влияя на важные для анализа характеристики. Поэтому аналитики считают комплексными соединениями продукты взаимодействия центрального атома с лигандами, независимо от наличия заряда у образующегося соединения и возможности его препаративного выделения. Соответственно, комплексом (комплексной частицей) они называют ион или молекулу, в состав которых входят более простые частицы, способные к самостоятельному существованию в растворе (или в составе кристалла). Примерами могут быть анионный комплекс Fe(SCN)63–, нейтральный комплекс FeСl3 или катионный комплекс Cu(NH3)42+. А вот сульфат-анион комплексом не является, так как атомы кислорода и серы в соответствующих степенях окисления не способны к самостоятельному существованию в растворе.
Способность комплексообразователя образовывать определенное число химических связей с лигандами характеризуют его координационным числом. Чаще всего оно равно 4 или 6. В анализе применяют устойчивые комплексные соединения переходных металлов, свинца, олова, алюминия, редкоземельных элементов и т. п. Однако широко используются и такие комплексы, в которых центральным атомом является неметалл (например, As или P).
Число связей, которые единичный лиганд образует с комплексообразователем, называют дентатностью. Неорганические лиганды обычно монодентатны: аммиак, вода, фторид-, хлорид-, цианид-ион и др. Бидентатными лигандами являются некоторые двухзарядные анионы (например, сульфат SO42–), бифункциональные органические соединения (диамины, многие аминокислоты и оксикислоты, оксалат С2О42 и другие анионы двухосновных карбоновых кислот). Существуют и лиганды с более высокой дентатностью, соответствующие органические молекулы содержат 3–6 функциональных групп донорного характера, каждая из которых образует одну связь с центральным атомом. Эти функциональные группы (-ОН, -СООН, -NH2 и некоторые другие) имеют неподеленные электронные пары, обеспечивающие образование связи с комплексообразователем.
Наибольшую практическую значимость имеют такие комплексы, которые содержат один центральный атом, а вся его координационная сфера заполнена одинаковыми лигандами. Однако в анализе применяются и комплексы более сложной структуры. В частности:
· полиядерные, содержащие несколько комплексообразователей,
· смешаннолигандные, содержащие лиганды разного типа,
· ненасыщенные, т. е. такие, где часть мест в координационной сфере центрального атома занята молекулами растворителя.
Соотношение между координационным числом комплексообразователя и дентатностью лиганда определяет возможный состав комплекса. Так, катион Al3+ с координационным числом 6 может присоединить 6 монодентатных лигандов (пример – фторидный комплекс AlF63–), или 3 бидентатных лиганда (оксалатный комплекс Al(С2О4)33–), или 2 тридентатных лиганда. Учитываются и пространственные (стерические) факторы. Так, если молекула монодентатного лиганда очень велика по объему, и несколько таких молекул у одного и того же комплексообразователя не помещаются, то в координационной сфере центрального атома свободные места занимают молекулы растворителя или какого-либо другого лиганда.
Комплексы с полидентатными лигандами называют хелатами. Разные функциональные группы одного и того же лиганда захватывают центральный атом с разных сторон, как клешня краба (слово «хелат» в переводе с греческого обозначает клешню). Нередко молекула реагента превращается в лиганд, теряя атомы водорода, в этом случае раствор подкисляется. Примером может быть взаимодействие щавелевой кислоты с ионами цинка, в ходе которого образуется оксалатный комплекс:
2 H2C2O4 + Zn2+ ÆZn(С2O4)2 2– + 4 H+
Структура оксалатного комплекса цинка(II)
Традиционно используемые структурные формулы комплексных соединений имеют условный характер, на самом деле эти соединения имеют трехмерную, пространственную структуру, которую трудно передать схемой на плоскости.
В структуре хелатов можно выделить циклические группы из нескольких атомов. В цикл входит и центральный атом. Образование циклов увеличивает устойчивость комплексов (так называемый хелатоэффект). Особой прочностью отличаются комплексы с 5- или 6-членными циклами. В приведенной выше структуре комплекса цинка можно выделить два пятичленных цикла.
Наиболее широко в анализе используют реакции образования хелатных комплексов с участием комплексонов – полидентатных лигандов, обычно представляющих собой анионы полиаминополикарбоновых кислот (раздел 4.5).
Комплексные соединения классифицируют по равновесным и по кинетическим характеристикам. По величине константы равновесия выделяют устойчивые и неустойчивые комплексы (четкого количественного критерия здесь нет). По скорости образования и скорости разрушения выделяют инертные и лабильны е комплексы. Условно граница между ними определяется временем достижения равновесия в реакции с участием 0,1 М растворов: если оно меньше 1 мин, то комплекс называют лабильным, если больше – инертным. Эти две классификации не связаны друг с другом. Наиболее желательный случай – когда комплексы являются и лабильными, и устойчивыми.
Константы равновесий комплексообразования. Координационное число центрального атома и дентатность лиганда часто не совпадают, тогда реакция образования комплексов происходит ступенчато. Обозначая катион металла символом М, а лиганд символом R (заряды опускаем), можно[1] записать равновесия комплексообразования следующим образом:
M + R ÆM R
M R + R ÆM R2
…
M Rn–1 + R ÆM Rn
Образование комплекса в каждом из этих процессов характеризуется ступенчатой константой устойчивости (концентрационной):
К 1 = 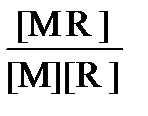 ; К 2 =
; К 2 = 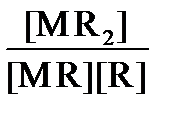 ; К n =
; К n = 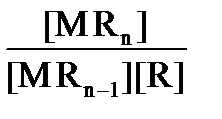 .
.
Иногда используют и константы обратных процессов, т. е. процессов диссоциации комплексов – константы нестойкости (пользоваться ими теперь не рекомендуется). Очевидно, что константа нестойкости комплекса – величина, обратная его константе устойчивости: К нест = 1/ К уст. Чем прочнее образующийся комплекс, тем выше его константа устойчивости и меньше константа нестойкости.
Помимо констант отдельных ступеней комплексообразования, образование комплекса из металла и нескольких лигандов можно характеризовать суммарной, или общей, константой устойчивости b. Например, для комплекса MR2 рассматривают процесс
M + 2 R ÆMR2,
константа равновесия которого равна:
b 2 = 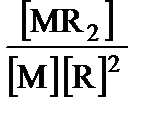 .
.
В общем случае для i -го комплекса
b i = 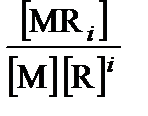 . (3.43)
. (3.43)
Очевидна связь между ступенчатыми и суммарными константами устойчивости:
b 1 = К 1; b 2 = К 1 К 2 ; b n = К 1· К 2 · … · К n-1· К n.
Логарифмы общих констант устойчивости равны сумме логарифмов соответствующих ступенчатых констант, что позволяет переходить от констант одного типа к другим. В справочниках обычно приводят величины lg bi всех комплексов, образуемых данным металлом с данным лигандом в водном растворе.
Равновесия комплексообразования при протекании побочных реакций описывают условными константами устойчивости. Из формулы (3.12) следует:
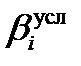 =
=  = b i a M
= b i a M  . (3.44)
. (3.44)
М и R могут образовывать комплексы не только друг с другом, но одновременно с этим процессом и другими компонентами раствора. Они также могут образовывать малорастворимые соединения, вступать в протолитические и окислительно-восстановительные реакции. При протекании любой побочной реакции мольные доли a M и a R (или одна из них) оказываются меньше единицы, а условная константа устойчивости – меньше концентрационной. Говорят, что при протекании побочных реакций комплекс становится менее устойчивым, но это выражение не точно – прочность связей внутри комплекса не меняется, но побочные реакции снижают степень протекания основной реакции и мольную долю комплекса в суммарной концентрации всех форм М.
Очень важно предвидеть влияние рН. Многие лиганды участвуют в конкурирующих протолитических реакциях. Если лиганд представляет собой анион слабой кислоты, то он проявляет свойства слабого основания. Тогда в кислой среде будет идти конкурирующая реакция перехода R в HR. Величина 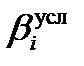 и степень образования комплекса будут снижаться тем сильнее, чем ниже величина рН. Вместе с тем для катионов М характерно образование гидроксокомплексов и малорастворимых гидроксидов. В наибольшей степени такие реакции происходят в щелочных средах. Величина
и степень образования комплекса будут снижаться тем сильнее, чем ниже величина рН. Вместе с тем для катионов М характерно образование гидроксокомплексов и малорастворимых гидроксидов. В наибольшей степени такие реакции происходят в щелочных средах. Величина 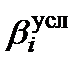 и степень образования комплекса в этом случае также снижаются тем сильнее, чем выше рН. Очевидно, зависимость
и степень образования комплекса в этом случае также снижаются тем сильнее, чем выше рН. Очевидно, зависимость 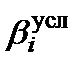 от рН имеет вид кривой с максимумом, но где он находится – в слабокислой, нейтральной или слабощелочной среде – определяется природой M и R. Зная константы равновесия всех побочных реакций, можно точно рассчитать, при каком рН процесс образования некоторого комплекса пойдет в максимальной степени. Качественно судить об этом можно с применением ионных диаграмм, показывающих состояние M и R при разных рН.
от рН имеет вид кривой с максимумом, но где он находится – в слабокислой, нейтральной или слабощелочной среде – определяется природой M и R. Зная константы равновесия всех побочных реакций, можно точно рассчитать, при каком рН процесс образования некоторого комплекса пойдет в максимальной степени. Качественно судить об этом можно с применением ионных диаграмм, показывающих состояние M и R при разных рН.
Обобщенной характеристикой процесса служит функция закомплексованности. Так называют отношение общей концентрации металла к равновесной концентрации свободных ионов Мn+:
Ф = 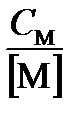 . (3.45)
. (3.45)
Величина Ф меняется в пределах от 1 (отсутствие комплексообразования) до очень высоких значений. При большом избытке лиганда и высоких значениях констант устойчивости значение Ф реально доходит до 1010–1020, что указывает на практически полное связывание М в комплексные соединения.
Расчетную формулу для функции закомплексованности выведем из уравнения материального баланса по металлу:
С М = [M] + [MR] + [MR2] + … + [MRn].
Равновесные концентрации разных комплексов выразим через [M] и [R] с учетом (3.43):
С М = [M] + b 1 [M][R] + b 2 [M][R]2 + … + b n [M][R]n =
= [M] (1 + b 1[R] + b 2[R]2 + … + b n [R]n) = [M] (1 + 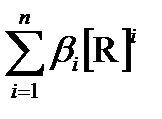 ).
).
Но, как следует из (3.45), С М = [M] Ф.
Сопоставив эти выражения, получаем искомую формулу:
Ф = 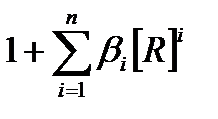 . (3.46)
. (3.46)
Формула (3.46) показывает, что закомплексованность металла возрастает при увеличении концентрации свободного лиганда, причем возрастает нелинейно. Ту же формулу можно выразить в логарифмической форме:
Ф = 1 + 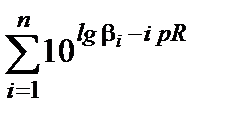 . (3.47)
. (3.47)
Формулу (3.45) можно использовать для расчета равновесной концентрации катиона металла и его мольной доли:
a М = 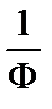 ; (3.48)
; (3.48)
[M] = 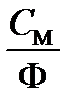 . (3.49)
. (3.49)
Пример 3.10. Рассчитать равновесную концентрацию ионов Ag+ в водном растворе, где концентрация AgNO3 равна 0,01 моль/л, а аммиака – 1 моль/л.
Решение. Очевидно, в данном растворе возможно образование аммиачных комплексов серебра, поэтому концентрация ионов Ag+ будет составлять лишь небольшую часть от общей концентрации серебра(I). Выпишем из справочника значения lg bi для аммиачных комплексов серебра. Они равны lg b 1 = 3,32; lg b 2 = 7,23. Так как по условиям задачи аммиак введен в очень большом избытке, [NH3] ≈ С(NH3) = 1 моль/л. Следовательно, входящая в формулу (3.47) величина pR равна
–lg[NH3] = 0, что существенно упрощает расчет закомплексованности по формуле (3.47): Ф = 1 + 103,32 + 107,23. Очевидно, всеми слагаемыми, кроме последнего, можно пренебречь. Ф ≈ 107,23. Теперь можно найти равновесную концентрацию «свободных» (не связанных с аммиаком) катионов серебра:
[Ag+] = 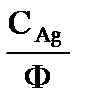 ≈
≈ 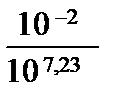 ≈ 10–9,23 ≈ 5,9·10–10 моль/л.
≈ 10–9,23 ≈ 5,9·10–10 моль/л.
Исключительно низкая концентрация ионов Ag+ приведет к важным следствиям. В присутствии аммиака осадок Ag2O не образуется даже в сильнощелочной среде. Не удастся обнаружить Ag+ и с помощью многих других характерных реакций. В таких случаях говорят, что металл замаскирован.
Маскирование. При определении некоторого Мхимическими методами влияние мешающего компонента М* стараются устранить без удаления М* из исследуемого раствора, т. е. путем маскирования. Маскирующее вещество R должно реагировать с М*, но не с М. Чаще всего для маскирования применяют реакции комплексообразования. Мешающие компоненты пробы переводят в достаточно прочные и хорошо растворимые комплексы. В результате равновесная концентрация ионной формы М* снижается. Концентрацию R подбирают так, чтобы равновесная концентрация М* снизилась до уровня, при котором М* не мешает определению М. При выборе маскирующего реагента учитывают особенности методики анализа. Например, во многих случаях (в качественном анализе, в титриметрии, в фотометрии) надо, чтобы комплекс М* с R был бесцветным. Некоторые методики анализа предполагают в дальнейшем демаскирование, т. е. разрушение комплекса с ранее замаскированным компонентом – в этом случае нельзя, чтобы комплекс был слишком устойчивым или инертным.
В качестве маскирующих реагентов-лигандов для катионов металлов часто используют аммиак, тиосульфат, фториды, полифосфаты, а также комплексоны, оксикислоты (винная, лимонная и др.), соли этих кислот, полиамины и другие органические вещества. Обычно лиганд при маскировании вводят в избытке, чтобы получить наиболее насыщенный комплекс MR и.
Если известно, какой должна оказаться равновесная концентрация металла [M*] (или его молярная доля, или функция закомплексованности) в результате маскирования, то минимально необходимую концентрацию маскирующего лиганда можно заранее рассчитать. Запишем уравнение ЗДМ для комплекса M*Rn и преобразуем его. Для удобства записи далее не будем приводить индекс (*), уточняющий, что речь идет о мешающем, а не об определяемом металле.
b n = 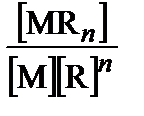 ; [R]=
; [R]= 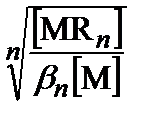 .
.
При полном маскировании можно принять, что [MRn] ≈ С М, и преобразовать последнее уравнение в одну из удобных для расчета форм:
[R] =  =
=  =
= 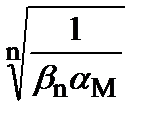 . (3.50)
. (3.50)
Те же формулы применяются для расчета концентрации реагента, предотвращающего образование осадков с участием определяемого металла.
Пример 3.11. Предложите способ, позволяющий предотвратить образование осадка гидроксида железа(III) в растворе с рН = 6. Общая концентрация железа(III) – 0,10 моль/л.
Решение. В растворе с рН 6 концентрация [OH–]-ионов невелика (10– 8 М), но вполне достаточна, чтобы в отсутствие маскирующих реагентов образовался осадок Fe(OH)3. Исходя из величины ПР осадка, определим, до какого уровня надо понизить концентрацию Fe3+, чтобы осадок не выпадал:
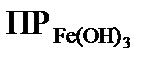 = [Fe3+][OH–]3 = 6,3·10–38 ;
= [Fe3+][OH–]3 = 6,3·10–38 ;
[Fe3+] = 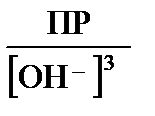 =
= 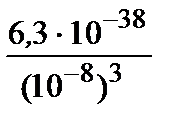 = 6,3·10–14 М.
= 6,3·10–14 М.
Таким образом, функция закомплексованности Ф должна составить
Ф = 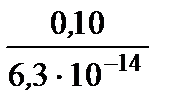 = 1,6·1012.
= 1,6·1012.
Для создания такой высокой закомплексованности необходимо перевести Fe3+ в достаточно прочные комплексы, например, фторидные. Допустим, что в растворе образуется только комплекс FeF63–. Для него lg b 6 = 16,10; b 6 = 1,3·1016. Концентрацию фторид-иона можно рассчитать по уравнению (3.50):
[F–] = 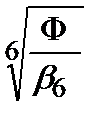 =
= 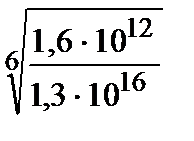 = 0,22 М.
= 0,22 М.
Очевидно, для маскирования в раствор необходимо ввести лиганд в количестве, отвечающем стехиометрии комплекса, плюс свободные фторид-ионы в рассчитанной концентрации. Общая концентрация фторидов (например, в виде фторида калия) в растворе должна составить
 > 6·0,1 + 0,22 = 0,82 М.
> 6·0,1 + 0,22 = 0,82 М.
В растворе возможна конкурирующая реакция протолиза аниона F–, однако при рН = 6 эта реакция протекает в незначительной степени, ее можно не учитывать.
Cостав смеси комплексов при ступенчатом комплексообразовании. В таких случаяхсостояние М в растворе определить довольно сложно, поскольку одновременно присутствуют катион металла и комплексные частицы с разным соотношением М:R. Состав смеси характеризуют мольные доли отдельных форм и построенные на их основе распределительные диаграммы. Соответствующий математический аппарат был создан в 30-х гг. XX века скандинавскими химиками. Применение теории ступенчатого комплексообразования в аналитической химии – заслуга видного отечественного ученого А.К. Бабко и его школы (40–50-е гг.).
Мольная доля i -го комплекса в смеси разных форм М равна:
a МR i = 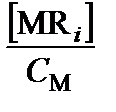 .
.
Концентрацию i -го комплекса выразим через [M] с помощью формулы (3.43), а общую концентрацию металла – с помощью (3.49). После несложных алгебраических преобразований получаем искомую формулу:
a МR i = 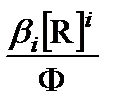 . (3.51)
. (3.51)
Распределительные диаграммы строят в координатах ai = f [R] или ai = f (pR) (где pR = –lg [R] – показатель концентрации лиганда) на основании формул (3.49) и (3.51). Каждому комплексу соответствует своя кривая на распределительной диаграмме.
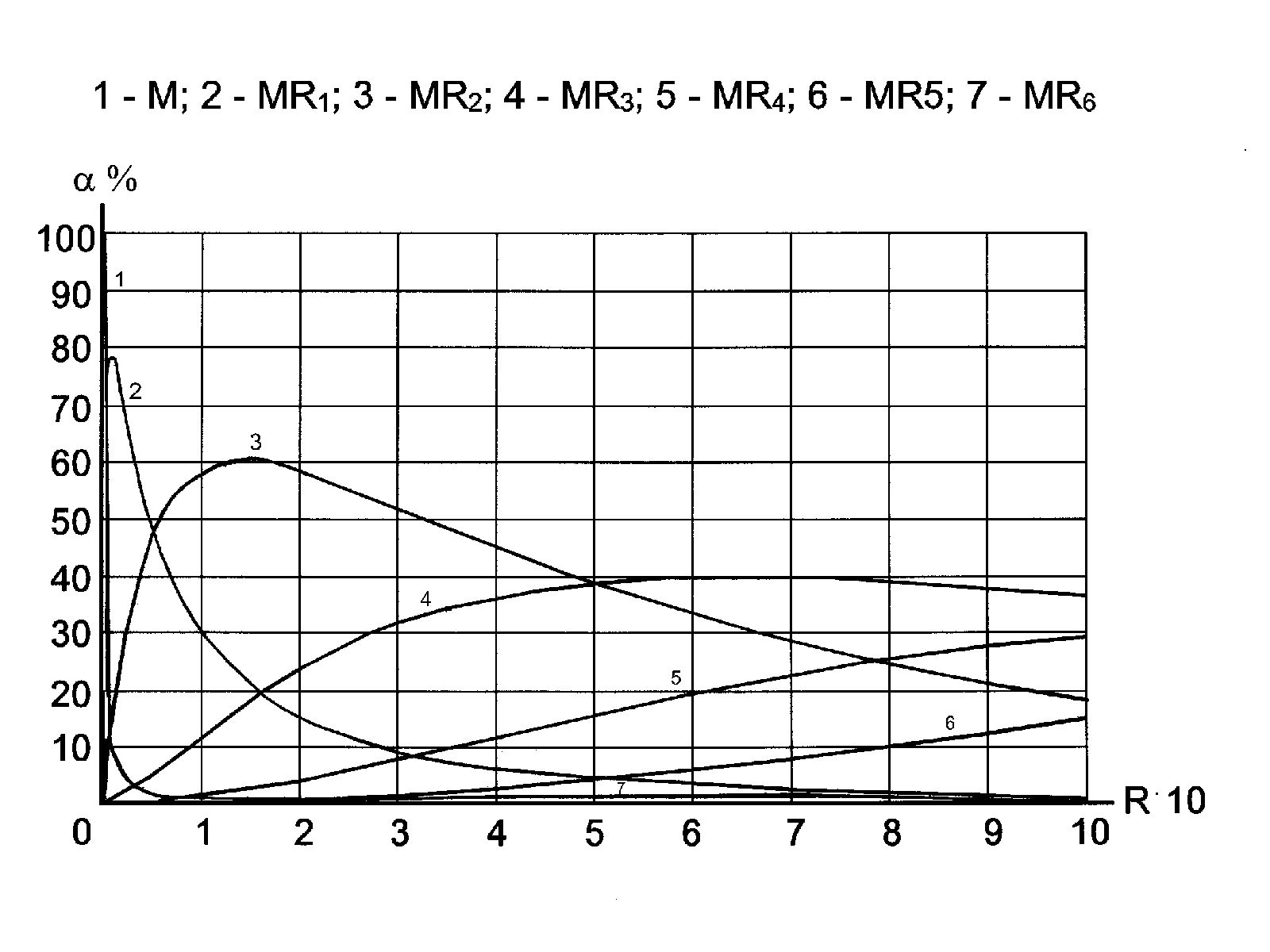
Рис. 3.7. Распределительная диаграмма для процесса образования роданидных комплексов железа(III)
1 – M; 2 – MR1; 3 – MR2; 4 – MR3; 5 – MR4; 6 – MR5; 7 – MR6
Концентрация избыточного лиганда – это тот фактор, которым аналитик пользуется для смещения равновесий комплексообразования в нужном направлении. Чем больше эта концентрация, тем сильнее равновесие смещено в сторону образования насыщенного комплекса. Наоборот, при низкой концентрации в смеси продуктов реакции комплексообразования доминируют ненасыщенные комплексы, а то и несвязанные в комплекс ионы М.
Из формулы (3.51) следует, что состояние М в растворе не зависит от общей концентрации М. В первом приближении это действительно так, но при сильном снижении общей концентрации М (на несколько порядков) может сказаться влияние побочных процессов.
Часто для проведения анализа требуется не просто связать М в комплексные соединения, но и перевести М в определенный («единственный») комплекс. Добиваясь этого, создают условия, обеспечивающие для некоторого комплекса практически 100-процентный выход (ai ≈ 1). Значение [R], при котором наблюдается максимум соответствующей кривой, находят на распределительной диаграмме. Однако можно ли будет в этих условиях пренебречь существованием остальных комплексов – зависит от соотношения ступенчатых констант устойчивости. В некоторых системах M–R это вообще невозможно, в других количественно может образовываться только наиболее насыщенный комплекс (при достаточно высокой концентрации избыточного лиганда). Образование ненасыщенного комплекса в качестве «единственного» возможно лишь в тех системах, где комплексы сильно различаются по устойчивости. Примеры соответствующих расчетов приведены в дополнительной литературе.
[1] В действительности катион металла в водном растворе гидратирован, присутствует в виде аквакомплекса, и реакции комплексообразования с другими лигандами представляют собой реакции замещения молекул воды во внутренней координационной сфере.
| <== предыдущая | | | следующая ==> |
| | | Предлагаем вам принять участие во Всероссийской акции |
Date: 2015-08-15; view: 4598; Нарушение авторских прав