
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние внешних факторов на величину электродного потенциала
|
|
Величина окислительно-восстановительного потенциала (ОВ-потенциала) зависит от химической природы материала электрода, температуры, концентрации и природы потенциалопределяющих частиц в растворе. Эта зависимость выражается уравнением Нернста:
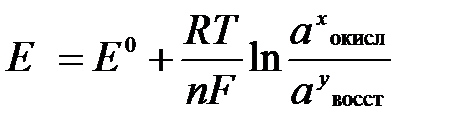 (2)
(2)
В этом уравнении Е – электродный потенциал (В); Е 0- стандартный электродный потенциал (В); R = 8,31 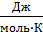 универсальная газовая постоянная; Т -температура (К); n – число моль электронов в полуреакции; F –число Фарадея; a окисл-активность окисленной формы потенциалопределяющих частиц (моль/л); a восст – активность восстановленной формы потенциалопределяющих частиц (моль/л).
универсальная газовая постоянная; Т -температура (К); n – число моль электронов в полуреакции; F –число Фарадея; a окисл-активность окисленной формы потенциалопределяющих частиц (моль/л); a восст – активность восстановленной формы потенциалопределяющих частиц (моль/л).
Введем несколько упрощений:
1) при стандартной температуре 298К и переходе к десятичным логарифмам, получим 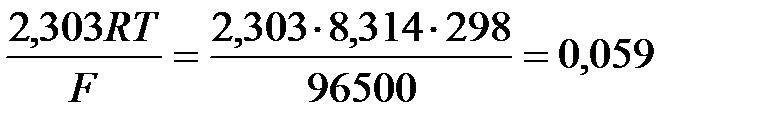 В;
В;
2) для разбавленных растворов активности с достаточным приближением могут быть заменены концентрациями (a окисл=[окисл], a восст =[восст]). В результате для стандартной температуры уравнение принимает следующий вид:
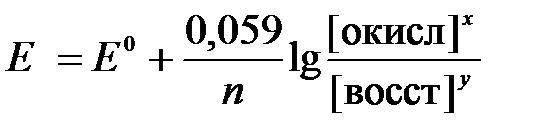 (3)
(3)
где «х» и «y» коэффициенты перед окисленной и восстановленной формой потенциалопределяющих частиц в ОВ-полуреакции.
Например, для полуреакции окисления ионов Mn2+
Mn2++4H2O - 5 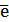 = MnO4- + 8H+,
= MnO4- + 8H+,
в которой слева – восстановленная форма потенциалопределяющих частиц, а справа – окисленная форма, уравнение Нернста для стандартной температуры будет иметь следующий вид:
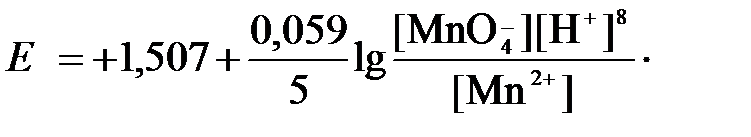
Подлогарифмическое выражение является константой равновесия реакции:
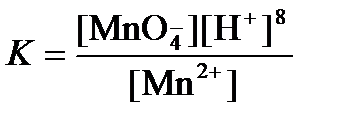 , поэтому уравнение (3) может быть представлено в
, поэтому уравнение (3) может быть представлено в
следующем виде:
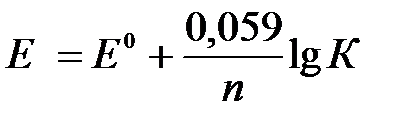 . (4)
. (4)
Если электродная система состоит из металлического электрода, опущенного в раствор, содержащий одноименные ионы Me0 - n 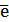 = Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид:
= Me+n, то уравнение Нернста при стандартной температуре приобретает следующий вид: 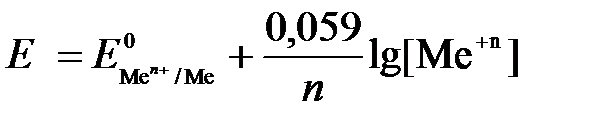 (5)
(5)
Для окислительно-восстановительных реакций исходя из соотношения Δ G 0х.р = -nF Δ Е иln K = - Δ G 0х.р /RT можно вычислить значения константы равновесия:
ln К =  (6)
(6)
Е ок – потенциал окислителя, Е восс- потенциал восстановителя.
Для стандартной температуры и десятичных логарифмов:
lg К = 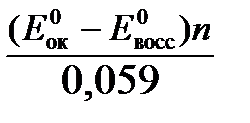 . (7)
. (7)
Date: 2015-07-27; view: 735; Нарушение авторских прав