
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

VI. Электрический ток в электролитах
|
|
Электролиты – жидкие или твердые вещества и системы, в которых присутствуют в заметной концентрации ионы, обусловливающие прохождение по ним электрического тока (ионную проводимость). Электролиты – растворы веществ, молекулы которых распадаются в растворе на ионы. В электролите под влиянием электрического поля молекулы растворителя происходит распад молекул растворенного вещества электролита на отдельные положительно и отрицательно заряженные ионы. Этот процесс называется – электролитической диссоциацией.
По способности к электролитической диссоциации электролиты условно делятся на сильные и слабые.
К сильным электролитам относятся соли, некоторые органические кислоты и основания, к слабым – многие органические соли и основания. Степень диссоциации 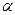 зависит от природы растворителя, температуры, давления и других факторов. Степенью диссоциации называется отношение числа диссоциированных молекул электролита к общему числу его молекул:
зависит от природы растворителя, температуры, давления и других факторов. Степенью диссоциации называется отношение числа диссоциированных молекул электролита к общему числу его молекул: 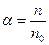 .
.
При прохождении электрического тока через электролит на опущенных в него электродах происходят окислительно–восстановительные реакции, в результате которых выделяются в свободном виде вещества, входящие в состав электролита. На катоде обычно выделяется химически чистый металл. Вблизи анода выделяется газ.
Электролиз – совокупность электрохимических процессов, проходящих на электродах, погруженных в электролит, при прохождении по нему электрического тока.
Проводимость электролитов – ионная, прохождение тока в них связанно с переносом вещества. На аноде происходит электрохимическое окисление — отрицательно заряженные ионы становятся нейтральными атомами и выделяются из раствора, а на катоде – восстановительная реакция: положительные ионы получают недостающие электроны.
Основные законы электролиза были установлены экспериментально М.Фарадеем в 1833–34 гг.
I закон Фарадея: Масса осевшего на катоде металла прямо пропорциональна количеству электричества прошедшего через электролит: m=kq.
Так как q=It, то согласно 1–му закону Фарадея, масса m выделившегося на катоде вещества прямо пропорциональна времени t прохождения через электролит тока и силе тока I: m=klt.
Коэффициент пропорциональности k называется электрохимическим эквивалентом вещества.
II закон Фарадея устанавливает связь электрохимического эквивалента с химическим эквивалентом: 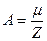 , где
, где 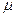 – молярная (или атомная) масса, Z–заряд иона в единицах абсолютной величины заряда электрона е:
– молярная (или атомная) масса, Z–заряд иона в единицах абсолютной величины заряда электрона е: 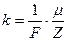 , где F- постоянная Фарадея, численно равная заряду, который должен пройти через электролит, чтобы на электроде выделилась масса вещества, численно равная молярной или атомной массе. Этот заряд переносят ионы, количество которых в массе вещества, численно равной химическому эквиваленту, составляет
, где F- постоянная Фарадея, численно равная заряду, который должен пройти через электролит, чтобы на электроде выделилась масса вещества, численно равная молярной или атомной массе. Этот заряд переносят ионы, количество которых в массе вещества, численно равной химическому эквиваленту, составляет 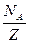 ,где
,где 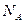 -число Авогадро(число молекул в 1 моль вещества
-число Авогадро(число молекул в 1 моль вещества 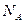 =6.022·10
=6.022·10 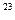 моль
моль 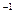 ). Поэтому
). Поэтому 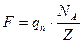 , где
, где 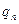 - заряд одного иона.
- заряд одного иона.
Так как заряд одного иона 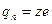 , то
, то 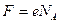 =96500 Кл/моль.
=96500 Кл/моль.
Электролиз лежит в основе электрохимического метода получения чистых веществ, а также используется для создания тонких слоев одних веществ на поверхности других (никелирование, хромирование и т.д.).
Date: 2015-08-06; view: 594; Нарушение авторских прав