
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Заняття № 60 ____2011р
|
|
Тема: Поняття про теорію Бора. Будова атома гідрогену. Енергетичні рівні в атомі. Випромінювання і поглинання енергії атомом Походження суцільного і лінійчатого спектрів. Явище люмінесценції і його закономірності. Флуоресценція і фосфоресценція. Квантові генератори та їх застосування.
Основні положення та означення.
1.Оскільки світло випромінюється і поглинається атомами речовини, то виникає питання: яка структура атомів забезпечує квантовий характер вказаних процесів? Відповідь на це питання дав Резерфорд (1911р), аналізуючи результати експериментального дослідження розсіяння 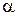 -частинок на тонких металічних плівках. Він запропонував ядерну модель атома, згідно з якою:
-частинок на тонких металічних плівках. Він запропонував ядерну модель атома, згідно з якою:
- в центрі атома
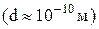 розміщене позитивно заряджене ядро
розміщене позитивно заряджене ядро  , в якому сконцентрована практично вся маса атома.
, в якому сконцентрована практично вся маса атома. - навколо ядер по колових чи еліптичних орбітах рухаються електрони. Якщо в нейтральному атомі Z електронів, то заряд ядра
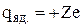 , де
, де 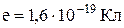 – елементарний заряд
– елементарний заряд
2. Недоліки моделі Резерфорда. - Рух електрона по орбіті є прискореним, і тому, з точки зору класичної фізики, електрон, що рухається прискорено, повинен випромінювати електромагнітні хвилі, втрачати енергію і кінець кінцем впасти на ядро. Але атом – стійка система електричних зарядів. І тому, приймаючи ядерну модель атома, потрібно відмовитись від класичного опису орбітального руху електронів.
3. Недоліки моделі Резерфорда було усунено в моделі, яку розробив Н. Бор (1913 р.). В основі моделі Бора лежать два наступні постулати:
-
 1. Атому властиві цілком стійкі стаціонарні стани з відповідними значеннями енергії Е1, Е2, ….. Еn, перебуваючи в яких, атом не випромінює і не поглинає енергії Наслідок : із усіх можливих механічних станів (орбіт) електрон в атомі може перебувати лише на таких, радіус яких визначається із співвідношення
1. Атому властиві цілком стійкі стаціонарні стани з відповідними значеннями енергії Е1, Е2, ….. Еn, перебуваючи в яких, атом не випромінює і не поглинає енергії Наслідок : із усіх можливих механічних станів (орбіт) електрон в атомі може перебувати лише на таких, радіус яких визначається із співвідношення 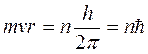
де 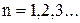 – номер орбіти, Такі стани (орбіти) називаються стаціонарними;
– номер орбіти, Такі стани (орбіти) називаються стаціонарними;
- 2. При переході з одного стаціонарного стану на інший електрон випромінює або поглинає квант світла з енергією, рівною різниці енергій цих станів, тобто
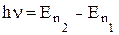
4. Отже, основна ідея постулатів Бора полягає в квантуванні механічних характеристик руху електронів в атомі (моменту імпульса, енергії тощо) і в стрибкоподібній зміні цих характеристик.
5. Вперше ядерна модель атома з постулатами Бора була застосована до воднеподібних атомів 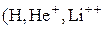 тощо), в яких навколо ядра рухається по коловій орбіті радіусом r лише один електрон. При цьому ядро вважається нерухомим, а електрон розглядається як класична матеріальна точка. Враховуючи, що в ролі доцентрової сили виступає кулонівська сила взаємодії між електроном та ядром, тобто
тощо), в яких навколо ядра рухається по коловій орбіті радіусом r лише один електрон. При цьому ядро вважається нерухомим, а електрон розглядається як класична матеріальна точка. Враховуючи, що в ролі доцентрової сили виступає кулонівська сила взаємодії між електроном та ядром, тобто 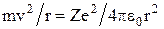 , отримаємо для радіуса стаціонарної орбіти електрона вираз,
, отримаємо для радіуса стаціонарної орбіти електрона вираз, 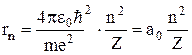 де
де 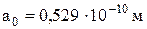 – борівський радіус, який має зміст радіуса першої (
– борівський радіус, який має зміст радіуса першої (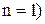 орбіти електрона в атомі водню (
орбіти електрона в атомі водню (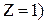 . Отже, має місце квантування радіусів стаціонарних орбіт електрона, оскільки
. Отже, має місце квантування радіусів стаціонарних орбіт електрона, оскільки 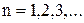 .
.
6. Для повної механічної енергії електрона 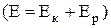 легко отримати вираз
легко отримати вираз
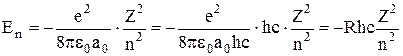 ,
,
де 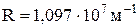 – постійна Рідберга.
– постійна Рідберга.
7. Отже, енергія воднеподібних атомів в стаціонарних станах приймає дискретні значення, тобто квантується. Стан з найнижчою енергією 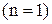 називається основним, усі інші стани – збудженими. Стан з найвищою енергією
називається основним, усі інші стани – збудженими. Стан з найвищою енергією 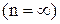 відповідає іонізації атома. Отже, енергія іонізації воднеподібних атомів
відповідає іонізації атома. Отже, енергія іонізації воднеподібних атомів 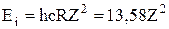 , (еВ).. Відповідно енергія на довільному рівні в атомі водню виражатиметься:
, (еВ).. Відповідно енергія на довільному рівні в атомі водню виражатиметься: 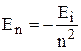
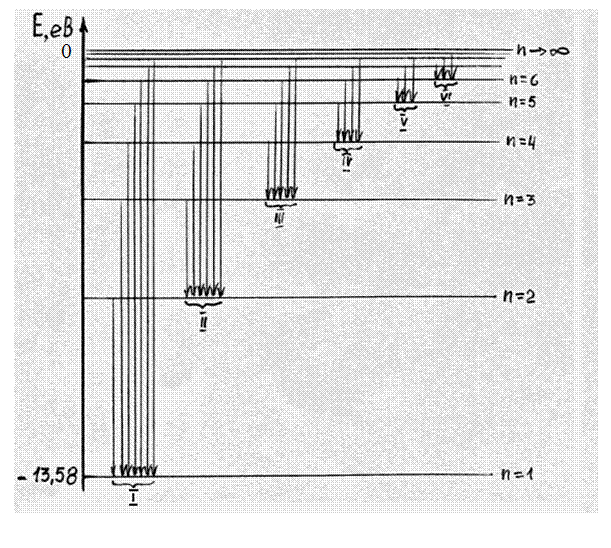
8. Зобразимо енергетичну діаграму борівського атома водню ( . В основному стані атом може перебувати як завгодно довго. Якщо ж його перевести певним чином (теплом, світлом, ударом вільних електронів тощо) в збуджений стан, то тривалість перебування в цьому стані складає
. В основному стані атом може перебувати як завгодно довго. Якщо ж його перевести певним чином (теплом, світлом, ударом вільних електронів тощо) в збуджений стан, то тривалість перебування в цьому стані складає  , і атом самовільно переходить в основний чи нижчі збуджені стани, випромінюючи фотони з енергіями
, і атом самовільно переходить в основний чи нижчі збуджені стани, випромінюючи фотони з енергіями
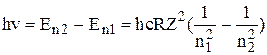 .
.
9. Довжини випромінюваних світлових хвиль розраховуються за серіальною формулою Бальмера:
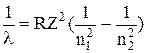 ,
,
де n2 – квантове число стану, з якого відбувається перехід, n1 – квантове число стану, в який переходить атом.
10. Усі спектральні лінії можна згрупувати в наступні серії: І–серія Лаймана (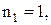 n2
n2  ; ІІ–серія Бальмера (
; ІІ–серія Бальмера (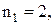
 ІІІ–серія Пашена (
ІІІ–серія Пашена (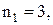
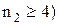 тощо. Лінії серії Лаймана лежать в ультрафіолетовій області, серії Бальмера – у видимій області, серії Пашена – в інфрачервоній області.
тощо. Лінії серії Лаймана лежать в ультрафіолетовій області, серії Бальмера – у видимій області, серії Пашена – в інфрачервоній області.
11. Теорія Бора дуже добре описала положення спектральних ліній випромінювання воднеподібних атомів, але виявилась нездатною пояснити спектри випромінювання складних атомів, а також інтенсивності спектральних ліній навіть атомарного водню. Слабкість цієї теорії зумовлена її непослідовністю: вона – напівкласична, напівквантова.
Date: 2015-08-06; view: 388; Нарушение авторских прав