
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Биологический код
|
|
Биосинтез белков, или трансляция, отличается от биосинтеза ДНК и РНК (репликации ДНК и трансляции РНК) двумя принципиальными особенностями: между мРНК (матрицей) и пептидной цепью белка, которая на этой матрице синтезируется, нет комплементарного соответствия, т.е. структура рибонуклеотидов (мономеров матрицы) и аминокислот (мономеров белка) такова, что избирательные взаимодействия между ними, подобные образованию пар А…Т или Г…Ц, невозможны, нет соответствия между числом мономеров – нуклеотидов в матрице и в продукте реакции (в мРНК 4 разных нуклеотида, в белке 20 разных аминокислот);
Поэтому механизм использования матрицы при биосинтезе белка отличается от использования матриц при репликации и транскрипции.
Способ записи информации о первичной структуре белков в нуклеиновых кислотах получил название биологического кода (его также называют генетическим, нуклеотидным, аминокислотным кодом).
Один из первых вопросов, который возникает при выяснении структуры биологического кода, – это вопрос о кодовом числе; т.е. о числе нуклеотидных остатков, кодирующих включение в белок одной аминокислоты. Очевидно, что кодовое число не может быть равным единице, так как в этом случае с помощью четырех нуклеотидов можно было бы закодировать только четыре аминокислоты. При кодовом числе 2 количество разных нуклеотидных пар будет равно числу перестановок из четырех элементов по 2, т.е равно 42 = 16, что тоже недостаточно для кодирования всех аминокислот. Число разных троек нуклеотидов равно 43 = 64. Это в три с лишним раза превышает минимальное число необходимое для кодирования 20 аминокислот. Экспериментально доказано, что в биологическом коде кодовое число равно трем: тройку нуклеотидных остатков (триплет), кодирующих включение одной аминокислоты, называют кодоном.
Из 64 кодонов (триплетов), (табл.1) 61 используется для кодирования аминокислот, а три – УАА, УAГ и УГA – обозначают конец матрицы: на этих триплетах обрывается дальнейшее наращивание пептидной цепи – терминирующие кодоны. Каждый триплет кодирует только какую-нибудь одну аминокислоту. Это свойство кода называют специфичностью. С другой стороны, одна аминокислота может кодироваться двумя или большим числом (до шести) разных триплетов, т.е. код вырожденный, но первые два нуклеотида для данной аминокислоты всегда одинаковы. Непрерывность кода белкового синтеза состоит в том, что все входящие в его состав кодоны располагаются в мРНК, кодирующей биосинтез определенного белка, в строгом порядке один возле другого, не будучи разделенными иными моно- или олигонуклеотидными вставками. Неперекрывающийся характер кода заключается в том, что ни один из нуклеотидов одного кодона не является составной частью другого (соседнего) кодона.
К настоящему времени биологический код изучен у всех биологических объектов (от вирусов и бактерий до высших животных). Во всех случаях он оказался одинаковым. Эта универсальность кода свидетельствует о единстве происхождения всех форм жизни на Земле.
Таблица 1 – Биологический код
| У | Ц | A | Г | ||||
| Первая буква | У | 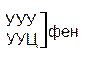
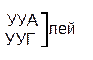
| 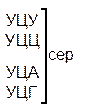
| 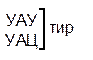
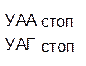
| 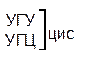
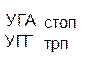
| У Ц А Г | Третья буква |
| Ц | 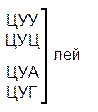
| 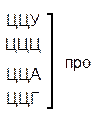
| 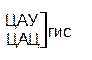
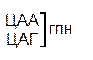
| 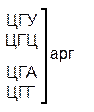
|  У
Ц
А
Г
У
Ц
А
Г
| ||
| A | 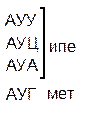
| 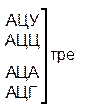
| 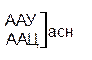
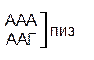
| 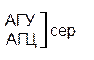
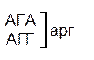
| У Ц А Г | ||
| Г | 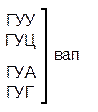
| 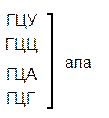
| 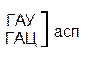
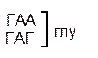
| 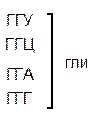
| У Ц А Г | ||
Генетический код, состоящий из 64 триплетов – оснований (кодонов) и соответствующих им аминокислот
3.4 Схема передачи генетической информации
от ДНК к белку
Допустим, что на определенном участке одной из спиралей молекулы ДНК, на которой синтезируется мРНК, мы имеем определенную последовательность нуклеотидов. Синтезированная на этом участке мРНК может иметь лишь строго определенную, комплементарную ДНК последовательность нуклеотидов (учитывая, что урацил РНК соответствует тимину ДНК). «Считывая» нуклеотидный код мРНК справа налево (от N-конца полипептида к С-концу), получим определенную последовательность аминокислот в данном полипептиде, который может синтезироваться под генетическим контролем этого участка молекулы ДНК.
Перенос информации от ДНК к белку можно изобразить в виде схемы:
| ДНК | Г А А | | | | | | ЦТ Т | А Ц Т | | | | | | Т Г A | Ц Г Г | | | | | | Г Ц Ц | A T T | | | | | | Т A A | – …Нетранскрибируемая цепь …Кодоны ДНК |
| мРНК | | | | Г А А | | | | А Ц У | | | | Ц Г Г | | | | A У У | …Кодоны мРНК |
| Белок | Глутами-новая кислота | Треонин | Аргинин | Изолейцин | …Аминокислотная последовательность |
3.5 Биосинтез белков – трансляция
Сборка полипептидной цепи белка из составляющих ее аминокислот включает четыре стадии: активацию и отбор аминокислот; инициацию синтеза полипептидной цепи; элонгоцию (удлинение) полипептидной цепи; терминацию синтеза полипептидной цепи.
Первая стадия – активация – это превращение аминокислоты в аминоацил – тРНК.
Взаимодействие тРНК с аминокислотами – ферментативный процесс, приводящий к образованию ковалентной сложноэфирной связи между аминокислотой и тРНК.
синтетаза
Аминокислота + АТФ + т РНК–––––® Аминоацил – тРНК + АМФ+ Н4Р2О7
Известно не менее двадцати различных аминоацил – тРНК – синтетаз, каждая из которых катализирует реакцию только одной из 20 аминокислот с тРНК, соответствующей этой аминокислоте. Каждая синтетаза высокоспецифична, в ее активном центре находится участок, комплементарный какой-то части молекулы одной из тРНК. Это позволяет каждой синтетазе соединять определенную аминокислоту с соответствующей тРНК.
Вторая стадия синтеза белка – инициация – начинается с образования инициирующего комплекса.
Поступившая из ядра в цитоплазму мРНК соединяется с малой (40 S) субъединицей рибосомы и инициирующим ей аминоацилом – тРНК. Затем к этому комплексу присоединяется большая (60 S) субъединица рибосомы.
Инициирующий аминоацил – тРНК – содержит аминокислоту метионин – Меt – тРНК. В дальнейшем Меt – тРНК взаимодействует своим триплетом нуклеотидов, комплементарным кодом АУГ или ЦУЦ на мРНК. Эти два кодона на мРНК называют инициирующими. С одного из них начинается синтез любого белка.
Третья стадия – элонгация. Процесс элонгации начинается со связывания аминоацил – тРНК – с инициирующим комплексом, соответствующим первому кодону мРНК, следующему за инициирующим кодоном. Кодон мРНК должен спариваться с антикодоном, т.е. с таким триплетом в молекуле тРНК, который комплементарно ему соответствует. Эта тРНК взаимодействует затем не только с мРНК, но и с определенными участками рибосомы – центрами связывания – пептидильным (донорным) и акцепторным. В процессе связывания аминоацила – тРНК– расходуется одна молекула ГTФ. Затем начинается образование пептидной связи между инициаторным метионином из Меt-тРНК и первой в будущей полипептидной цепи аминокислотой, включенной в аминоацил-тРНК. Образовавшийся дипептидил – тРНК – связан с кодоном, соответствующим аминокислоте, и центром связывания рибосомы.
Затем происходит транслокация – перемещение рибосомы относительно мРНК и дипептидил-тРНК. В результате этого перемещения дипептидил-тРНК оказывается в пептидильном центре рибосомы, а тРНК метионина освобождается из комплекса. На транслокацию расходуется две молекулы ГTФ.
Дальнейшее удлинение пептидной цепи происходит путем повторения этих фаз, но теперь уже присоединяется аминоацетил-тРНК, соответствующий второму коноду мРНК, в результате чего образуется трипептид и т.д.(рис 3):
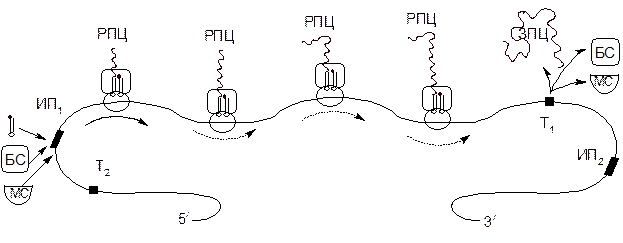
Рисунок 3 – Схема действия полирибосомы, состоящей из четырех рибосом
МС– малая субчастица рибосомы (40S); БС – большая частица рибосомы (60S); РПЦ и ЗПЦ – растущая и завершенная полипептидные цепи; ИП1 и ИП2 – кодоны – инициаторы и участок, узнаваемый рРНК; Т1 и Т2 – кодоны–терминаторы, прерывающие синтез белка.
Остаток аминокислоты инициаторного метионина, участвовавший в стадии инициации и занимающий в растущей пептидной цепи N-концевое положение, отщепляется в стадии элонгации.
Следует отметить, что метионин, встраиваемый не в начало цепи (инициаторный метионин), а внутри – переносится другой тРНК.
Четвертая стадия – терминация. Удлинение пептидной цепи продолжается до тех пор, пока на пути рибосомы не встретится один из терминальных триплетов мРНК. Это триплеты УAA, УAГ или УГA, сигнализирующие окончание синтеза полипептидной цепи. В узнавании этих терминальных конодов участвуют внерибосомные белки – факторы терминации или факторы высвобождения белка, под действием которых происходит гидролитическое расщепление связи между полипептидом и последней тРНК, и высвобождается полипептидная цепь готового белка. После освобождения полипептидной цепи фактор высвобождения, а также мРНК диссоциируют. У растений обнаружен лишь один фактор.
Вторичная и третичная структуры белков формируются в процессе трансляции по мере удлинения пептидной цепи. Как уже отмечалось в разделе «Белки», пространственные структуры белковой молекулы определяются первичной структурой ее полипептидной цепи. В результате формирования вторичной и третичной структур образуются активные центры белков.
В то же время в процессе трансляции и после ее завершения не всегда формируется биологически активный белок. В ряде случаев сформированные молекулы белков-ферментов неактивны, и переход их в активную форму возможен после отщепления части полипептидной цепи путем частичного гидролиза. Так, например, в созревающих семенах ферменты протеазы синтезируются в неактивной форме, они не способны гидролизовать собственные запасные белки до прохождения частичного гидролиза полипептидной цепи молекулы фермента. Только после частичного гидролиза, в результате которого отщепляются трипептид, протеаза переходит в активную форму и начинает гидролизовать запасные белки семян. Продукты гидролиза белков поступают в прорастающий зародыш семени.
Присоединение к молекуле белка простетической группы – кофермента или металла, объединение олигомерных белков в четвертичную структуру также происходят уже после завершения процесса трансляции. В некоторых белках после завершения синтеза полипептидной цепи происходит модификация аминокислотных остатков, например, присоединение дополнительных метильных групп, йодирование, окисление двух остатков цистеина с образованием дисульфидного мостика, гидроксилирование остатков пролина, присоединение сахаров к остатку аспарагина при образовании гликопротеинов, фосфорилирование гидроксильных групп серина или тирозина у некоторых ферментов, присоединение КоА в ацилпереносящем белке синтетазы жирных кислот.
В реальной живой клетке синтез белков протекает не на одной рибосоме, а на комплексе или кластере рибосом – полисоме. Каждая стадия трансляции (инициация, элонгация и терминация) осуществляется каждой рибосомой. Обычно кластеры содержат от 3 до 20 рибосом, но очень большие молекулы мРНК, состоящие из тысяч нуклеотидов, могут образовывать комплексы, содержащие от 50 до 100 рибосом. Скорость синтеза полипептида очень высока: синтез пептида из 100 аминокислот занимает около 2 минут.
Общая схема процесса синтеза белка может быть представлена в следующем виде:
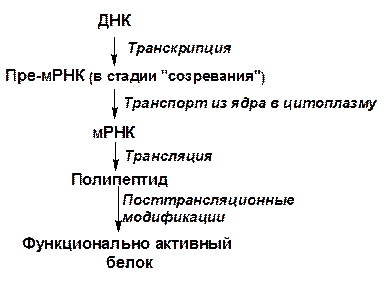
Date: 2015-08-06; view: 3639; Нарушение авторских прав