
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Пример 3. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
|
|
Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2, большую прочность связей в молекулярных ионах F2+ и О2+, чем, соответственно, в молекулах F2 и О2; меньшую прочность связи в ионе N2+, чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2; и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомных, соответствует более высокая энергия, чем атомным орбиталям. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр.) электронами. Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
усв1s<уразр1s<усв2s<уразр2s<усв2рx<рсв2ру=рсв2рz<рразр2ру=рразр2рz<уразр2рx
Энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода дана в учебнике «Химия» Н.Л. Глинка
Следует отметить, что при образовании молекул В2, С2 и N2 энергия связывающей у2рх,-орбитали больше энергии связывающих р2pу- и р2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих р2pу- и р2рz-орбитапей больше энергии связывающей у2рх-орбитали. Это нужно учитывать при изображении энергетических схем («Химия» Н.Л. Глинка) соответствующих молекул.
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
ТЕМА: Энергетика химических процессов (термохимические расчеты)
При решении задач этого раздела данные для расчетов необходимо взять в таблице этого раздела и в справочнике физико-химических величин.
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного течения различных процессов в данных условиях.
В результате химических реакций происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах и возникают новые связи в конечных продуктах. Эти изменения сопровождаются поглощением или выделением энергии. В большинстве случаев этой энергией является теплота. Раздел термодинамики, изучающий тепловые эффекты химических реакций, называют термохимией. Реакции, которые сопровождаются выделением теплоты, называют экзотермическими, а те, которые сопровождаются поглощением теплоты, — эндотермическими. Теплоты реакций являются, таким образом, мерой изменения свойств системы, и знание их может иметь большое значение при определении условий протекания тех или иных реакций.
При любом процессе соблюдается закон сохранения энергии как проявление более общего закона природы — закона сохранения материи. Теплота Q, поглощенная системой, идет на изменение ее внутренней энергии ДU и на совершение работы А:
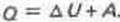
Внутренняя анергия системы U— это общий ее запас, включающий энергию поступательного и вращательного движения молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Внутренняя энергия — полная энергия системы без потенциальной энергии, обусловленной положением системы в пространстве, и без кинетической энергии системы как целого. Абсолютное значение внутренней энергии U веществ неизвестно, так как нельзя привести систему в состояние, лишенное энергии. Внутренняя энергия, как и любой вид энергии, является функцией состояния, т.е. ее изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс
ДU = U2 — U1,
где ДU — изменение внутренней энергии системы при переходе от начального состояния U1 в конечное U2. Если U2 > U1, то ДU > 0. Если U2 < U1, то ДU < 0.
Теплота и работа функциями состояния не являются, ибо они служат формами передачи энергии и связаны с процессом, а не с состоянием системы. При химически реакциях А — это работа против внешнего давления, т.е. в первом приближении А = сДV, где ДV - изменение объема системы (V2 – V1). Так как большинство химических реакций проходит при постоянном давлении, то для иэобарно-изотермического процесса (p-const, Т-const) теплота
Qр = ДU + сДV,
Qр = (U2 — U1) + с(V2 – V1)
Сумму U + сV обозначим через Н, тогда
Qр= Н2 - Н1= ДН
Величину Н называют энтальпией. Таким образом, теплота при р=соnst и T=сопst приобретает свойство функции состояния и не зависит от пути, по которому протекает процесс. Отсюда теплота реакции в изобарно-изотермическом процессе Qp равна изменению энтальпии системы ДН (если единственным видом работы является работа расширения):
Энтальпия, как и внутренняя энергия, является функцией состояния; ее изменение {ДН} определяется только начальными и конечными состояниями системы и не зависит от пути перехода. Нетрудно видеть, что теплота реакции в изохорно-изотермическом процессе (Vсonst; T=соnst), при котором ДV = 0, равна изменению внутренней энергии системы:Qv=ДU
Теплоты химических процессов, протекающих при р, Т=соnst V,T=const, называют тепловыми аффектами.
При экзотермических реакциях энтальпия системы уменьшается и ДН < О (H2 < H1), а при эндотермических энтальпия системы увеличивается и ДH > О (H2>H1). В дальнейшем тепловые эффекты всюду выражаются через ДН.
Термохимические расчеты основаны на законе Гесса: тепловой эффект реакции зависит только от природы и физического состояния исходных веществ и конечных продуктов, но не зависит от пути перехода.
Часто в термохимических расчетах применяют следствие из закона Гесса: тепловой эффект реакции ДHх.р. равен сумме теплот образования ДНобр продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом коэффициентов перед формулами этих веществ в уравнении реакции.
Date: 2015-07-25; view: 1406; Нарушение авторских прав