
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тепловое самовоспламенение (тепловой взрыв)
|
|
Самовоспламенение – это явление резкого увеличения скорости экзо-термических реакций, приводящее к самопроизвольному возникновению го-рения вещества в отсутствии источника зажигания.
Теория теплового самовоспламенения разработана академиком Семе-новым Н.Н., который исходил из представления об ускорении реакций окис-ления с температурой и преобладания скорости тепловыделения над тепло-отводом.
При окислительной реакции, проходящей с полной отдачей образую-щегося тепла, горение не возникает. Горение возникает лишь в условиях рез-кого самоускорения химического процесса, связанного с накоплением либо тепла в системе (так называемое тепловое самовоспламенение), либо катали-зирующих промежуточных продуктов реакции (цепное самовоспламенение). Суть теории заключается в следующем. Рассмотрим поведение горючей сме-си, заключенной в сосуд объемом V с постоянной температурой стенок Т0. В смеси протекает химическая реакция. Температура во всех точках сосуда одинакова и равна Т.
Исходя из физико-химических свойств газов, рассмотренных нами Ра-нее, скорость химической реакций υр подчиняется соотношению
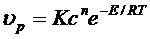 (6.1)
(6.1)
где: К – константа скорости реакций, зависящая от температуры;
с – концентрация реагирующих веществ;
n – порядок реакции;
Е – энергия активации реакции.
Скорость выделения тепла при реакции:
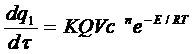 , (6.2)
, (6.2)
где: Q – тепловой эффект реакции;
V – объем сосуда;
τ – время.
Видно, что с повышением температуры скорость выделения тепла рас-тет по экспоненте.
Выделившееся тепло расходуется на нагрев смеси и потери в окру-жающую среду за счет теплопроводности и излучения.
Количество тепла, отводимое от поверхности сосуда в единицу времени выражается линейною зависимостью:
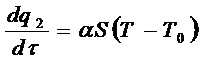 (6.3)
(6.3)
где: α – коэффициент теплоотдачи;
S – площадь поверхности стенок сосуда.
Тогда изменение подвода и отвода тепла в зависимости от температуры можно проиллюстрировать следующим образом (рис. 22):

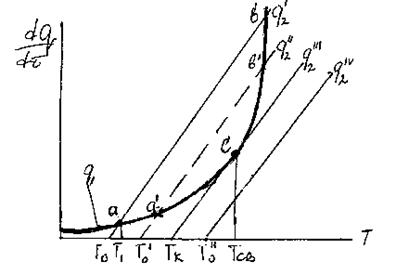
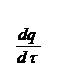
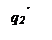




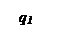

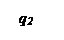
 Рис. 22. Соотношение теп-ловыделения и теплоотво-да при тепловом взрыве.
Рис. 22. Соотношение теп-ловыделения и теплоотво-да при тепловом взрыве.

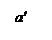





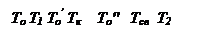
Три линии q 2 соответствуют трем значениям начальной температуры смеси То, Тк и То’.
Решающим условием возникновения процесса горения является пре-вышение или равенство скорости выделения тепла реакции над скоростью отдачи тепла реагирующей системой в окружающую среду, например, стен-кам реакционного сосуда.
При установившимся состоянии системы q 1= q 2 и температура в сосуде определяется как абсцисса точек пересечения линии q 1 с линиями q 2. Из ри-сунка видно, что линии прихода и отвода могут пересекаться в двух точках (точки a и b) либо в одной точке (точка с), либо не пересекаться.
Рассмотрим первый случай: нагрев смеси, имеющей начальную темпе-ратуру То. При T=Tо скорость теплоотвода по условиям равна нулю и хотя q1 невелико, реагирующий газ начинает нагреваться. С повышением температу-ры и q1 и q2 возрастают. Пока температура газа лежит в интервале между Т0 и Т1 он продолжает нагреваться. При достижении Т1 величины q1 и q2 сравни-ваются и температура газа становится постоянной. Состояние системы в этой точке является устойчивым. Если в результате случайных причин температу-ра газа превысит Т1 то теплоотвод скажется больше тепловыделения и систе-ма сама вернется в прежнее состояние. Если мы искусственно охладим газ, то он нагреется сам за счет реакции до T1. Режим медленной реакции, протее-кающий с практически постоянной скоростью при Т=T1 сохраняется дли-тельное время.
Вторая точка пересечения кривых (b) находится в области больших вы-соких температур, и режим тепловой реакции в этом случае будет неустой-чивым. При отклонении от равновесного состояния в точке b система в него уже не возвращается.
Повышение начальной температуры стенок сосуда То до То' приводит к смещению вправо линии теплоотвода q2. Значение стационарной температу-ры Т1 будет при этом плавно расти (точка а'), и при температуре стенки Тк линии подвода и отвода тепла будут касаться одна другой в точке С, которая является граничной точкой существования стационарного режима, неболь-шое повышение температуры стенки выше Тк будет сопровождаться превы-шением теплоприхода над теплоотводом, что вызовет повышение температу-ры смеси и соответственно, резкое ускорение реакции.
Этот процесс перехода от медленно протекающей реакций к прогрес-сивно ускоряющемуся возгоранию смеси, является процессом самовоспламе-нения. А температура, откладываемая на оси абсцисс от точки С – темпера-тура самовоспламенения Тсв.
Минимальную температуру стенок сосуда Тк, при которой смещение достигнет равенства q1 = q2” – называют критической температурой воспла-менения.
При повышении температуры сосуда до То" условия тепловыделения по-прежнему описываются кривой q1, тогда как прямая теплоотвода q2''' пере- местится вправо параллельно самой себе. При температуре То" сосуда тепло-приход больше теплоотвода при любой температуре газа, и температура газа, а с нею и скорость реакции, будут прогрессивно расти.
Температура сосуда, для которой прямая теплоотвода q2” касательна к кривой тепловыделения, является предельной для перехода от режима мед-ленной реакции к взрыву. При Tо>Tк скорость реакции и температура газа неограниченно увеличиваются и происходит тепловой взрыв. При Tо< Tк ус-танавливается стационарный режим, при котором скорость реакции мала.
Время, в течение которого в реагирующей системе достигается разо-грев от Ткр до Тсв, называется периодом индукции самовоспламенения.
Теория теплового самовоспламенения хорошо объясняет зависимость между давлением и температурой самовоспламенения горючей смеси. До-пустим, что сосуд, в который вводится смесь, имеет постоянную температуру То. При малых давлениях количество выделяющегося тепла не превышает количества отводимого тепла, и реакция протекает при постоянной темпера-туре, близкой к температуре сосуда.
При увеличении давления и соответственно, массы вещества выделяет-ся больше тепла, чем отводится, температура газов повышается и происходит их самовоспламенение. Наглядно зависимость теплоприхода и теплоотвода 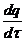 (где τ – время), от температуры при различных давлениях показана на ри
(где τ – время), от температуры при различных давлениях показана на ри  сунке 23:
сунке 23:
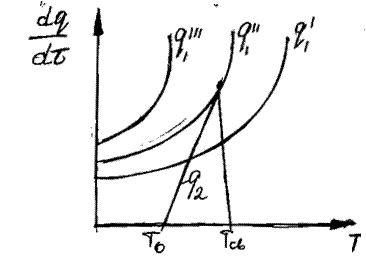
Рис. 23. Соотношение теплопри- хода и теплоотвода при различном давлении газовой смеси: q1' < q1" < q1'''
Тут 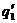
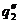
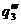 показывают тепловыделение при давлениях соответствен-но Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2 . Критические условия самовоспла-менения реализуются при давлении Р2 (кривая
показывают тепловыделение при давлениях соответствен-но Р1<Р2<Р3 при одинаковом составе смеси. Количество отводимого от зоны горения тепла характеризуется прямой q 2 . Критические условия самовоспла-менения реализуются при давлении Р2 (кривая 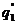 ).
).
Условия самовоспламенения предельного состава горючей смеси пока-зана на кривых 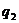 и
и 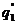 . В общем, условие теплового самовоспламенения сво-дится к тому, что начальный саморазогрев горючей смеси в результате реак-ции окисления должен превысить некоторое критическое значение
. В общем, условие теплового самовоспламенения сво-дится к тому, что начальный саморазогрев горючей смеси в результате реак-ции окисления должен превысить некоторое критическое значение 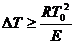 , называемое характеристическим интервалом температуры. Вывод этого по-казателя изложен в § 9.3.
, называемое характеристическим интервалом температуры. Вывод этого по-казателя изложен в § 9.3.
Зависимость температуры самовоспламенения от состава горючей сме-си показана на рисунке 24. Минимальная Тсв характерна для стехиометриче-ских смесей.

Рис. 24. Область самовоспламе-нения горючих смесей.
Date: 2015-07-27; view: 671; Нарушение авторских прав