
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния
|
|
В состоянии термодинамического равновесия объем V, давление Р и температура Т находятся в функциональной зависимости, которую можно выразить уравнением
F (P,V,T) = 0.
Это соотношение называется уравнением состояния тела (системы). Вид функции F(P,V,T) различен для разных тел и точно установлен только в одном случае, а именно для идеального газа. Идеальным называется газ, в котором
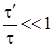 ,
,
где t¢ - среднее время столкновения частиц, t - среднее время свободного пробега частиц. При этом средняя длина свободного пробега частиц должна быть много меньше размеров сосуда, в котором заключен газ. Данные условия выполняются достаточно хорошо для газов, молекулы которых имеют простое строение даже при давлениях, близких к атмосферному.
Уравнение состояния идеального газа можно получить, рассмотрев давление, создаваемое газом на стенку сосуда. Оно возникает в результате передачи импульса участку стенки при столкновениях с ним молекул газа. Учитывая, что в равновесном состоянии соударения молекул в среднем носят упругий характер, давление идеального газа оказывается пропорциональным средней энергии поступательного движения частиц, заключенных в единице объема:
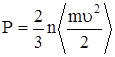 ,
,
где n – плотность (концентрация) частиц, n = N/V, N – число частиц.
Используя связь кинетической энергии молекул и температуры, получаем
P = nkT.
Существует несколько форм записи этого уравнения:
PV = NkT;
PV =  NAkT = nRT,
NAkT = nRT,
где n =  – количество вещества, R = NA×k = 8,31 Дж/(моль×К) – универсальная газовая постоянная. Используя выражение для количества вещества через массу и молярную массу газа можно получить известное уравнение Клапейрона – Менделеева
– количество вещества, R = NA×k = 8,31 Дж/(моль×К) – универсальная газовая постоянная. Используя выражение для количества вещества через массу и молярную массу газа можно получить известное уравнение Клапейрона – Менделеева
PV = 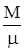 RT,
RT,
где М – масса газа, m – молярная масса газа.
Из последнего уравнения состояния можно получить известный закон Дальтона и уравнения изопроцессов:
а) давление механической смеси газов равно сумме парциальных давлений газов, входящих в смесь:
PV = ( )RT;
)RT;
б) изотермический процесс – Т=const, PV = const, P1V1 = P2V2;
изобарический процесс – P = const, 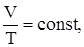
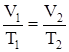 ;
;
изохорический процесс – V = const, 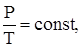
 .
.
Date: 2015-08-15; view: 523; Нарушение авторских прав