
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Витрати тепла
|
|
4.2.1. Витрати тепла на дисоціацію оксидів та переведення сірки в шлак.
4.2.1.1. Визначаємо кількість монооксиду заліза (FeOш.м.), внесеного шихтовими матеріалами:
- агломератом FeOАГ = АГ´FeO´0,01 = 169,00´14,59´0,01 = 24,66 кг;
- золою коксу * [2] FeOз.к. = К´АК´0,01´Feз.к. ´0,01´ 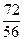 =
=
= 40,0´10,02´0,01´15,75´0,01´ 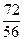 = 0,81 кг.
= 0,81 кг.
Всього: FeOш.м. = FeOАГ + FeOз.к. = 24,66 + 0,81 = 25,47 кг.
4.2.1.2. Кількість оксидів заліза в агломераті та шлаку:
FeOСИЛІКАТУ = FeOз.к.+ FeOАГ´10´0,01 = 0,81 + 24,66´10´0,01 = 3,28 кг,
де 10 – кількість FeO агломерату, зв’язаного в силікат (див. *14);
FeOМАГНЕТИТУ = FeOш.м. – FeOСИЛІКАТУ = 25,47 – 3,28 = 22,19 кг;
Fe2O3 МАГНЕТИТУ = FeOМАГНЕТИТУ´ 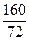 = 22,19´
= 22,19´ 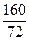 = 49,32 кг;
= 49,32 кг;
Fe2O3 ВІЛЬНА = Fe2O3 А – Fe2O3 МАГНЕТИТУ = 106,15 – 49,32 = 56,83 кг,
де Fe2O3 А – кількість Fe2O3 в агломераті (див. п. 2.4.1);
FeOш = 0,200 кг (див. п. 1.19).
4.2.1.3. Теплові ефекти реакцій, взятих за основу для подальших розрахунків, наведені в таблиці:
| Реакція | Тепловий ефект, ккал/моль | Перерахунок на 1 кг елементу чи оксиду |
| Fe + 0,5 O2 = FeO | на 1 кг FeO = 64430/72 = 895 ккал/кг | |
| 2FeO + SiO2 = Fe2SiO4 | на 1 кг FeO = 11300/(2´72) = 78,5 ккал/кг | |
| Разом: | 895 +78,5 = 973,5 ккал/кг | |
| 3Fe + 2O2 = Fe3O4 | на 1 кг Fe3O4 = 265960/232 = 1146,5 ккал/кг | |
| Fe + 1,5 O2 = Fe2O3 | на 1 кг Fe2O3 = 196910/160 = 1231 ккал/кг | |
| MnO + SiO2 = MnSiO4 | на 1 кг Mn = 7000/55 = 127 ккал/кг | |
| MnO = Mn + 0,5 O2 | –96720 | на 1 кг Mn = 96720/55 = 1758 ккал/кг |
| SiO2 = Si + O2 | –207850 | на 1 кг Si = 207850/28 = 7423 ккал/кг |
| Ca3(PO4)2 = 3CaO + P2O5 | –159500 | Разом: 159500 + 370000 = 529500 ккал, на 1 кг Р = 529000/(2*31) = 8540 ккал/кг |
| P2O5 = 2P + 2,5 O2 | –370000 |
4.2.1.4. Витрати тепла на дисоціацію оксидів заліза:
QДИС FenOm = (FeOСИЛІКАТУ – FeOш)´973,5 + (FeOМАГНЕТИТУ + Fe2O3 МАГНЕТИТУ)´1146,5 + + Fe2O3 ВІЛЬНА´1231 = (3,28 – 0,20)´973,5 + (22,19 + 49,32)´1146,5 + + 56,83´1231 = 154941,3 ккал (648708,4 кДж),
де 973,5; 1146,5 та 1231 – теплові ефекти утворення відповідних оксидів, ккал/кг (таблиця).
4.2.1.5. Витрати тепла на дисоціацію MnO (із силікату):
QДИС MnO = [Mn]´(127 + 1758) = 0,593´1885 = 1117,4 ккал (4678,3 кДж),
де [Mn] – вміст марганцю в чавуні, % (п. 1.2.7); 127 та 1758 – див. таблицю.
4.2.1.6. Витрати тепла на дисоціацію кремнезему:
QДИС SiO2 = [Si]´7423 = 0,55´7423 = 4082,8 ккал (17093,7 кДж),
де [Si] – вміст кремнію в чавуні, % (вих. дані, табл. 2); 7423 – див. таблицю.
4.2.1.7. Витрати тепла на дисоціацію фосфорно-кальцієвої солі:
QДИС Ca3(PO4)2×P2O5 = [Р]´8540 = 0,1395´8540 = 1191,5 ккал (4988,7 кДж),
де [Р] – вміст фосфору в чавуні, % (п. 1.3.4); 8540 – див. таблицю.
4.2.1.8. Витрати тепла на переведення сірки в шлак:
QCaS = 1368´Sш = 1368´0,850 = 1162,8 ккал (4868,5 кДж),
де 1368 – тепловий ефект (ккал/кгS) утворення сульфіду в реакції CaO + S = CaS + 0,5O2; Sш – кількість сірки, що переходить в шлак, кг (п. 1.15.3).
4.2.1.9. Загальні витрати тепла на дисоціацію оксидів та переведення сірки в шлак:
Qå ДИС = QДИС FenOm + QДИС MnO + QДИС SiO2 + QДИС Ca3(PO4)2×P2O5 + QCaS =
= 154941,3 + 1117,4 + 4082,8 + 1191,5 + 1162,8 = 162495,8 ккал (680337,6 кДж).
4.2.2. Витрати тепла на розкладання карбонатів:
QКАРБ = ВАП´(966´CaOвап´0,01´ 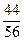 + 594´MgOвап´0,01´
+ 594´MgOвап´0,01´ 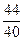 ) =
) =
= 2,26´(966´53,33´0,01´ 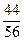 + 594´1,3´0,01´
+ 594´1,3´0,01´ 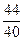 ) = 927,4 ккал (3883,0 кДж),
) = 927,4 ккал (3883,0 кДж),
де ВАП – витрата вапняку, кг (п. 1.13.2); 966 і 594 – кількість тепла на 1 кг СО2 при розкладанні CaCO3 та MgCO3 відповідно, ккал/кгСО2; СаОвап і MgOвап – вміст відповідних оксидів у вапняку, % (таблиця 4); 44, 56 та 40 – молекулярні маси СО2, СаО і MgO відповідно.
4.2.3. Витрата тепла на розкладання вологи дуття:
QН2Од = 2581´VН2Од = 2581´1,08 = 2779,5 ккал (11637,3 кДж),
де VН2Од – кількість водяного пару в дутті, м3 (п. 4.1.3.2); 2581 – тепло дисоціації водяного пару дуття (Н2О = Н2 + 0,5 О2 – 57810 ккал) на 1 м3 пари (57810/22,4 = 2581 ккал).
4.2.4. Витрата тепла на випаровування вологи шихти (tш = 100 °С).
4.2.4.1. Кількість вологи в шихті:
Wш = WК´К + Wвап´ВАП = 3,0´0,01´40,0 +2,0´0,01´2,26 = 1,245 кг,
де WК і К – вміст вологи в коксі, % (табл. 3) та його витрата, кг (табл. 2); (п. 4.1.3.2); Wвап і ВАП – вміст вологи в вапняку, % (табл. 4) та його витрата, кг (п. 1.13.2).
4.2.4.2. Витрати тепла за цією статтею:
QН2Ош = 640´Wш = 640´1,245 = 796,9 ккал (3336,4 кДж),
де 640 = 100 + 540 – сума витрат теплоти на нагрів шихти до 100 °С та випаровування з неї вологи, ккал/кг Н2О.
4.2.5. Втрати тепла з рідкими чавуном та шлаком:
- з чавуном: QЧАВ = 100´270 = 27000 ккал (113043,6 кДж);
- зі шлаком: QШЛ = 41,27´400 = 16507,4 ккал (69113,2 кДж),
де 270 і 400 – теплоємність чавуну та шлаку, ккал/кг; 41,27 – кількість шлаку (п. 1.20).
4.2.6. Втрати тепла з колошниковим газом, водяним паром і колошниковим пилом (tкг = 300 °С).
4.2.6.1. Теплоємність при температурі 300 °С:
- газу – СКГ = 0,333 ккал/м3×град (1,394 кДж);
- водяного пару – СН2О = 0,368 ккал/кг×град (1,541 кДж);
- пилу – СКП = 0,2 ккал/кг×град (0,837 кДж).
4.2.6.2. Загальна кількість тепла, що втрачається за цією статтею:
QКГ = VКГ´СКГ´tкг + Wш´СН2О´(tкг – 100) + (МН2О+КП – Wш) ´СКП´tкг =
= 158,391´0,333´300 + 1,245´0,368´(300 – 100) + (6,96 – 1,245) ´0,2´300 =
= 16258,0 ккал (68069,2 кДж),
де VКГ – кількість колошникового газу, м3 (п. 2.7); Wш – кількість вологи в шихті, кг (п. 4.2.4.1); МН2О+КП – винос вологи та пилу шихтових матеріалів з колошниковим газом (п. 3.4).
4.2.7. Всього витрат тепла за статтями 4.2.1–4.2.6:
Qåвит = Qå ДИС + QКАРБ + QН2Од + QН2Ош + QЧАВ + QШЛ + QКГ =
= 162495,8 + 927,4 + 2779,5 + 796,9 + 27000 + 16507,4 + 16258,0 =
= 226765,2 ккал (949420,4 кДж).
4.2.8. Втрати тепла з водою для охолодження, з радіацією та конвекцією в зовнішній простір.
Коментар до розрахунку.
В цій статті обчислюється різниця між загальним приходом тепла Qåприх (п. 4.1.5) та його загальними витратами Qåвит (п. 4.2.7), яка в повному обсязі відноситься на втрати тепла з водою для охолодження, з радіацією та конвекцією в зовнішній простір, точне обчислення яких є вкрай складним (і недоцільним в даній роботі). В цю різницю входить і т.з. нев’язка теплового балансу (невідома за абсолютним значенням). Через такий підхід тепловий баланс за прийнятою розрахунковою схемою буде завжди «безпомилковим». Тим не менше, загальні цифри приходу та витрат тепла повинні відповідати даним з практики роботи доменних печей, за якими величина втрат тепла разом з нев’язкою повинна складати для переробного чавуну 4-12%, для ливарного – 8-15%.
Величина втрат тепла за статтею:
DQ = Qåприх - Qåвит = 252775,4 - 226765,2 = 26010,22 ккал (108899,6 кДж).
Зведена таблиця теплового балансу.
Як видно з таблиці (див. далі), розрахована величина втрат тепла разом з нев’язкою у процентному відношенні становить 10,29 %, що є прийнятним.
Зведена таблиця теплового балансу
| № п/п | Пункт в розрахунку | Статті балансу | ккал | кДж | % |
| 4.1. | ПРИХІД ТЕПЛА | ||||
| 4.1.1.3 | Окислення вуглецю | 204581,54 | 856541,99 | 80,93 | |
| 4.1.2 | Окислення водню | 3915,21 | 16392,19 | 1,55 | |
| 4.1.3.4 | Внесено нагрітим дуттям | 44278,63 | 186172,94 | 17,52 | |
| Разом: | 252775,38 | 1058319,94 | 100,00 | ||
| 4.2. | ВИТРАТИ ТЕПЛА | ||||
| 4.2.1.9 | Дисоціація оксидів | 162495,85 | 680337,61 | 64,28 | |
| 4.2.2 | Розкладання карбонатів | 927,43 | 3882,96 | 0,37 | |
| 4.2.3 | Дисоціація водяного пару | 2779,53 | 11637,34 | 1,10 | |
| 4.2.4 | Випаровування вологи шихти | 796,89 | 3336,44 | 0,32 | |
| 4.2.5 | Втрати тепла з чавуном | 27000,00 | 113043,60 | 10,68 | |
| 4.2.5 | Втрати тепла зі шлаком | 16507,41 | 69113,22 | 6,53 | |
| 4.2.6.2 | Втрати з колошниковим газом | 16258,05 | 68069,19 | 6,43 | |
| 4.2.8 | Інші втрати | 26010,22 | 108899,57 | 10,29 | |
| Разом: | 252775,38 | 1058319,94 | 100,00 |
4.2.10. Визначення коефіцієнта корисної дії тепла в доменній печі.
h Q = 100 – (QКГ + DQ) = 100 – (6,43 + 10,29) = 83,28 %,
де QКГ – втрати тепла (%) з колошниковим газом, водяним паром і колошниковим пилом; DQ – втрати тепла (%) з водою для охолодження, з радіацією та конвекцією в зовнішній простір, значення яких наведені в зведеній таблиці теплового балансу.
4.2.11. Розрахунок коефіцієнта використання вуглецю КС в доменній печі.
4.2.11.1. Прихід тепла від окислення вуглецю в СО і СО2 складає (п. 4.1.1.3):
QС = 204581,54 ккал.
4.2.11.2. Кількість вуглецю, що окислюється до СО і СО2 складає (п. 2.1.6):
Сок = 41,074 кг.
4.2.11.3. Теплове значення вуглецю, що окислився, складе:
xСок = QС / Сок = 204581,54 / 41,074 = 4980,8 ккал/кг (20853,6 кДж/кг).
4.2.11.4. Коефіцієнт використання вуглецю КС:
КС = (xСок / 7980) ´ 100 = 4980,8 / 7980 = 62,4 %,
де 7980 – кількість тепла, що виділяється при горінні 1 кг вуглецю до СО2, ккал/кг.
Список рекомендованої літератури
1. Методичні вказівки до виконання та оформлення курсових робіт з дисципліни «Металургія чавуну» для студентів денної форми навчання напряму підготовки 6.050401 - “Металлургія” / Уклад. С.Т. Пліскановський, Ю.О. Ступак. - Дніпропетровськ: ІнІФН НМетАУ, 2015.
2. Робоча програма, методичні вказівки і індивідуальні завдання до вивчення дисципліни “Металургія чавуну” та виконання курсової роботи для студентів спеціальностей: 7.090401, 7.090402 / Укл.: В.С.Терещенко, В.П.Іващенко, Вл.С.Терещенко - Дніпропетровськ: НМетАУ, 2006. - 39 с.
3. Плискановский С.Т., Полтавец В.В. Оборудование и эксплуатация доменных печей. Днепропетровск: Пороги, 2004.- 495 с.
4. Ефименко Г.Г., Гиммельфарб А.А., Левченко В.Е. Металлургия чугуна. -К.: Вища школа, 1988.-351 с.
5. Рамм А.Н. Современный доменный процесс. –М.: Металлургия, 1980. – 304 с.
6. СБОРНИК НАУЧНЫХ ТРУДОВ Черная металлургия России и стран СНГ в XXI веке. Том 2, Москва 1994.
7. Хзмалян Д.М., Каган Я.А. Теория горения и топочные устройства. –М.: Энергия, 1976. – 487 с.
8. Канторович Б.В. Введение в теорию горения и газификации твердого топлива. –М.: Металлургиздат, 1960. – 355 с.
9. ГОСТ 805-95 (взамен ГОСТ 805-80). Чугун передельный. Технические условия. –Минск: изд-во стандартов. – 1999.
10. Нащокин В.В. Техническая термодинамика и теплопередача. Уч. пособие. –М.: Высшая школа, 1975. – 496 с.
* [1] - в п. 4.1.1 опосередковано розраховується сумарне тепло, що утворюється від вуглецю коксу, який окислюється дуттям та вуглецю ПВП, що згорає у фурмених осередках (див. баланс вуглецю, п. 2.1). Тепло від окислювання водню до Н2О (п. 4.1.2) також враховує водень зі складу ПВП (див. баланс СН4 та Н2, п. 2.3)
*[2] - в розрахунку умовно прийнято, що в золі коксу %Fe = %FeO (п. 4.2.1.1). Крім того, прийнято, що в золі коксу все FeO зв’язане в силікат заліза, а а агломераті – лише 10% (стосується п. 4.2.1.2).
Date: 2015-07-27; view: 426; Нарушение авторских прав