
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Порядок выполнения работы. Опыт №1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде
Опыт №1. Влияние концентрации тиосульфата натрия на скорость его разложения в кислой среде.

Табл. 1. Приготовление растворов.
| № пробирки | Число капель | |||
| Na2S2O3 | H2O | H2SO4 | Всего | |
| - |
Табл. 2. Результаты опыта.
| № пробирки | Концентрация Na2S2O3 | lnCотн (Ci/C1) | Время реакции,τ, с | Скорость реакции, с-1 |
| C1 | 5,5 . 10-3 | |||
| 2C1 | 0,693 | 17,8 . 10-3 | ||
| 3C1 | 1,1 | 23,2 . 10-3 |
Найдем значения скорости реакции:



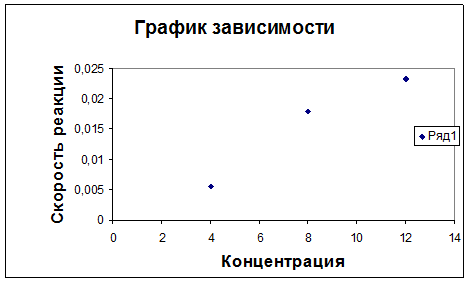
1. График зависимости скорости реакции от концентрации тиосульфата натрия.
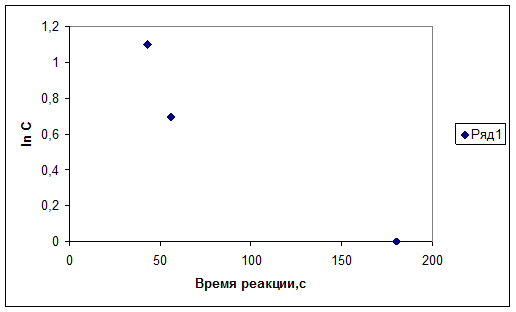
2. График зависимости логарифма относительной концентрации от времени протекания реакции.
Опыт №2. Влияние температуры на скорость реакции разложения тиосульфата натрия в кислой среде.
| № пробирки | Число капель | Температура, С0 | Время реакции,τ, с | Скорость реакции, с-1 | |
| Na2S2O3 | H2SO4 | ||||
| 0,01 | |||||
| 0,03 | |||||
| 0,04 |
При обработке результатов эксперимента воспользуемся правилом Вант-Гоффа:
При увеличении температуры на 10 K скорость химических реакций возрастает в 2-4 раза.
 ,
,
где γ – температурный коэффициент скорости реакции.

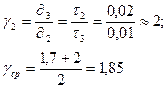
Путем проведения опыта было подтверждено эмпирическое правило Вант-Гоффа, только с незначительной погрешностью.
Теперь вычислим энергию активации реакции:
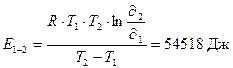

где R = 8,31 Дж/моль.K, T – температура в K,  i = скорость химической реакции.
i = скорость химической реакции.
Опыт №3. Влияние концентраций реагентов на равновесие обратимой реакции между хлоридом железа (III) и тиоцианатом аммония.
FeCl3 + 3NH4CNS  Fe(CNS)3 + 3NH4Cl
Fe(CNS)3 + 3NH4Cl
Налили в химический стаканчик по 5 мл 0,0025 н. растворов хлорида железа (III) и тиоцианата аммония, перемешали и разлили в 4 пробирки.
I. Без добавок реакция прошла плавно и получился продукт оранжевой окраски.
II. Здесь мы добавили FeCl3 (конц.), продукт окрасился в темно-оранжевый цвет; химическое равновесие сместилось вправо.
III. После добавления NH4CNS (конц.) продукт окрасился в темно-красный цвет; химическое равновесие сместилось вправо.
IV. Затем добавили NH4Cl, продукт окрасился в светло-бурый цвет, а химическое равновесие сместилось влево.
Вывод:
Проделав данные эксперименты, мы можем сделать некоторые выводы. Из опыта №1 следует, что при увеличении концентрации тиосульфата натрия скорость его разложения в кислой среде возрастает. Эта прямо-пропорциональная зависимость отражена в графике зависимости скорости реакции от концентрации реагента.
В опыте №2 мы подтвердили правило Вант-Гоффа, и выяснили, что с повышением температуры возрастает скорость химических реакций, т. к. увеличивается число активных молекул, способных к химическому взаимодействию. Эта зависимость скорости хим. реакций от температуры прямо-пропорциональная.
В опыте №3 мы убедились, что концентрация реагирующих веществ влияет на химическое равновесие следующим образом:
- если увеличить концентрацию реагентов, то хим. равновесие будет смещаться вправо;
Date: 2015-07-24; view: 994; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |