
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Фотоэнергетические реакции хлоропластов
|
|
Важнейшей функцией ЭТЦ хлоропластов является ее энергетическая функция — накопление солнечной энергии в форме соединений с высоким энергетическим потенциалом. Свободная энергия, освобождаемая в реакциях фотосинтетического транспорта электронов, запасается частично в форме восстановленных кофакторов (ФДВ0ССТ, НАДФН), большая часть поглощенной энергии используется для синтеза АТФ. Процессы образования этих соединений составляют основу биоэнергетики живых систем.
В 1954 г. Д.Арнон впервые показал, что хлоропласты при освещении способны синтезировать АТФ. Этот процесс, сопряженный с транспортом электронов в хлоропластах, получил название «фотосинтетическое фосфорилирование». Количество энергии, необходимой для синтеза молекулы АТФ, определяется потенциалом переноса фосфорильной группы и может быть описано уравнением
∆ GАТФ = ∆G 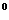 + 1,36 lg
+ 1,36 lg 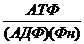 ,
,
где ∆G 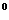 — стандартная свободная энергия гидролиза АТФ, равная -30,4 кДж/моль, или -0,34 эВ на молекулу. В хлоропластах, по данным ряда авторов, ∆ GАТФ = 56,4 кДж/моль.
— стандартная свободная энергия гидролиза АТФ, равная -30,4 кДж/моль, или -0,34 эВ на молекулу. В хлоропластах, по данным ряда авторов, ∆ GАТФ = 56,4 кДж/моль.
Источником свободной энергии для синтеза АТФ в хлоропластах является изменение свободной энергии в окислительно-восстановительных реакциях ЭТЦ. Энергия фотовозбужденного пигмента в реакционных центрах используется для разделения зарядов и запасается в форме окислительно-восстановительной энергии (Клейтон, 1984). В системе с разделенными зарядами электрон, удаленный от ядра при поглощении энергии кванта, обладает более высоким энергетическим потенциалом, который может быть реализован при обратном движении электрона через ряд переносчиков в сторону более электроположительных компонентов (по градиенту редокс-потенциала). При этом освобождается энергия, количество которой определяется разностью редокс-потенциалов реагирующих систем и может быть рассчитано по формуле
∆G 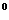 = -nF∆E'o,
= -nF∆E'o,
где ∆G 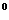 — стандартное изменение свободной энергии (кДж/моль); п — число электронов, участвующих в реакции; F — число Фарадея (96,4 кДж • В-1 • моль -1),
— стандартное изменение свободной энергии (кДж/моль); п — число электронов, участвующих в реакции; F — число Фарадея (96,4 кДж • В-1 • моль -1),
∆E'o — разность стандартных окислительно-восстановительных потенциалов реагирующих систем.
Расчеты показывают, что для образования макроэргической связи АТФ достаточна разность окислительно-восстановительного потенциала донора и акцептора электрона в 0,25 В.
Date: 2015-07-22; view: 1094; Нарушение авторских прав