
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Інгібітори ферментів,типи інгібірування. Приклади ефектів фізіологічно активних сполук та ксенобіотиків як зворотних (конкурентних, неконкурентних) та незворотних інгібіторів
|
|
Під терміном «інгібування ферментативної активності» розуміють зниження каталітичної активності в присутності певних речовин – інгібіторів. До інгібіторів відносять речовини, що викликають зниження активності ферменту. Потрібно зазначити, що всі денатуруючі агенти також викликають зменшення швидкості будь-якої ферментативної реакції, внаслідок неспецифічної денатурації білкової молекули, тому денатуруючі агенти до інгібіторів не відносять.
Інгібітори викликають велику зацікавленість під час вивчення механізмів ферментативного каталізу, допомагають встановити роль окремих ферментів у метаболічних шляхах організму. В основі дії багатьох лікарських препаратів і отрут лежить інгібування активності ферментів, тому знання механізмів цього процесу є дуже важливим для молекулярної фармакології і токсикології.
Інгібітори здатні взаємодіяти з ферментами з різним ступенем міцності. На основі цього розрізняють зворотне і незворотне інгібування. За механізмом дії інгібітори поділяють на конкурентні й неконкурентні.
Зворотне інгібування
Зворотні інгібітори зв’язуються з ферментами слабкими нековалентними зв’язками і за певних умов легко відокремлюються від ферменту.
До конкурентного інгібування відносять зворотне зниження швидкості ферментативної реакції, викликане інгібітором, що зв’язався з активним центром ферменту й перешкоджає утворенню ферментсубстратного комплексу. Такий тип інгібування спостерігають, коли інгібітор є структурним аналогом субстрату. В результаті даного типу інгібування виникає конкуренція молекул субстрату та інгібітора за місце зв’язування в активному центрі ферменту. В такому випадку з ферментом взаємодіє або субстрат, або інгібітор, утворюючи комплекси фермент – субстрат (ES) або фермент – інгібітор (ЕІ). Внаслідок формування комплексу ферменту та інгібітора продукт реакції не утворюється
Для конкурентного типу інгібування справедливі наступні рівняння:
E + S ↔ ES → E + P
E + I ↔ EI
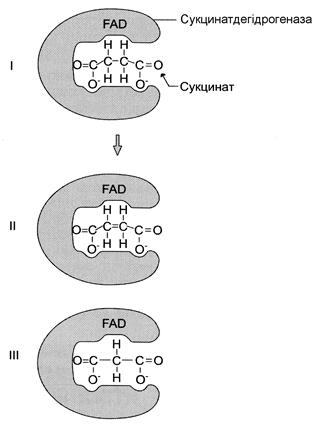
Класичний приклад конкурентного інгібування – інгібування сукцинат-дегідрогеназної реакції малоновою кислотою (рис. 22). Малонова кислота – структурний аналог сукцинату (наявність двох карбоксильних груп) і може також взаємодіяти з активним центром сукцинатдегідрогенази. Але відщеплення двох атомів водню від малонової кислоти є неможливим; отже, швидкість реакції знижується.
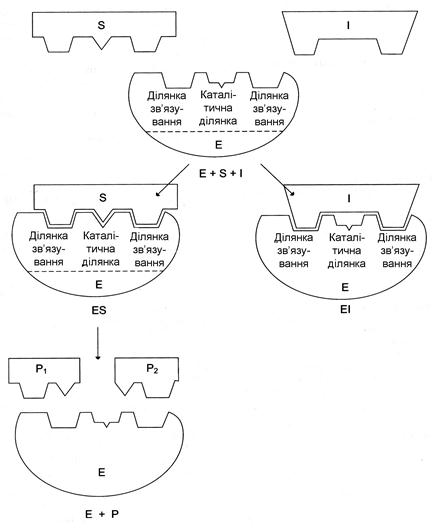
| Рис. | Схема конкурентного інгібування активності ферменту |
Конкурентні інгібітори зменшують швидкість хімічної реакції. Конкурентний інгібітор підвищує Km для даного субстрату (зменшує спорідненість субстрату до ферменту). Це означає, що в присутності конкурентного інгібітора необхідна велика концентрація субстрату для досягнення 1/2Vmax.
Збільшення співвідношення концентрації субстрату та інгібітора знижує ефективність інгібування. При значно вищих концентраціях субстрату інгібування повністю зникає, тому що активні центри усіх молекул ферменту будуть знаходитися переважно в комплексі з субстратом.
Date: 2015-07-23; view: 2660; Нарушение авторских прав