
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия активации
|
|
В процессе протекания реакций горения происходит перегруппировка химических связей между атомами. Например, в реакции 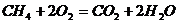 исходные связи С – Н и О – О заменяются связями С – О и Н – О. Для такой перегруппировки связей необходимо, чтобы реагирующие вещества обладали некоторой избыточной энергией. Дело в том, что при обычной температуре реакция между метаном и кислородом не происходит. Имеет место простое механическое столкновение молекул газов в результате их теплового движения, а реакция не идет. Нужна избыточная энергия – энергия активации.
исходные связи С – Н и О – О заменяются связями С – О и Н – О. Для такой перегруппировки связей необходимо, чтобы реагирующие вещества обладали некоторой избыточной энергией. Дело в том, что при обычной температуре реакция между метаном и кислородом не происходит. Имеет место простое механическое столкновение молекул газов в результате их теплового движения, а реакция не идет. Нужна избыточная энергия – энергия активации.
Энергия активации – это то минимальное количество избыточной энергии, которое необходимо иметь реагирующим веществам для разрыва или значительного ослабления внутримолекулярных связей, чтобы началась реакция. На практике энергия активации сообщается реагирующим веществам пламенем спички, зажигалки, запальника, электрической искрой и т.п. Для спички, т.е. для веществ входящих в состав головки спички, также нужна энергия активации – эта энергия сообщается при трении головки о специальную поверхность коробка.
Энергия активации является характеристикой активности молекул при реагировании между собой. Чем меньше энергия активации, тем легче молекулы вступают в реакцию. И наоборот, чем больше энергия активации, тем труднее молекулы вступают в реакцию. Энергию активации можно рассматривать как энергетический барьер, который нужно преодолеть, чтобы произошла реакция. Численное значение Е для большинства газовых смесей лежит в пределах от 80 до 170 кДж/моль.
Различают экзо- и эндотермические реакции. В результате протекания экзотермических реакций теплота выделяется. При эндотермических реакциях теплота поглощается. Все реакции горения горючих газов являются экзотермическими.
Кроме того, реакции горения подразделяются на гомогенные и гетерогенные. Гомогенные реакции – это реакции, протекающие между газами, т.е. когда нет границы раздела фаз. Гетерогенные реакции – это реакции, протекающие на поверхности жидких и твердых тел, т.е. когда есть поверхность раздела фаз. Например, горение угля, мазута и т.п.
1.3 Зависимость скорости химической реакции от различных факторов
Подставим уравнение Аррениуса в формулу 1. В результате получим:
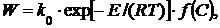 (3)
(3)
где k 0 – предэкспоненциальный множитель (константа);
E – энергия активации, кДж/кмоль;
R – газовая постоянная, кДж/(кмоль· К);
Т – абсолютная температура, К;
С – концентрация реагирующих веществ.
На величину скорости реакции (уравнение 3) влияют следующие факторы: природа реагирующих веществ, температура, концентрация, давление и катализаторы.
Зависимость  от природы реагирующих веществ проявляется через величину энергии активации. Чем больше
от природы реагирующих веществ проявляется через величину энергии активации. Чем больше  , тем меньше
, тем меньше  . И наоборот, чем меньше
. И наоборот, чем меньше  , тем больше величина
, тем больше величина 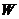 .
.
На величину 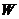 существенное влияние оказывает температура. Повышение температуры примерно на 10 градусов приводит к увеличению W в два раза. Для метановоздушных смесей повышение абсолютной температуры в два раза приводит к увеличению скорости горения в 5· 108 раза.
существенное влияние оказывает температура. Повышение температуры примерно на 10 градусов приводит к увеличению W в два раза. Для метановоздушных смесей повышение абсолютной температуры в два раза приводит к увеличению скорости горения в 5· 108 раза.
Из уравнения 3 видно, что с повышением концентрации 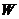 возрастает. Однако в газоиспользующие приборы и установки газ подается непрерывно, поэтому величина
возрастает. Однако в газоиспользующие приборы и установки газ подается непрерывно, поэтому величина 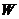 остается постоянной.
остается постоянной.
С повышением давления 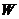 возрастает, т.к. при сжатии газов возрастает концентрация. В большинстве случаев сжигание газового топлива производится при атмосферном давлении, поэтому влияние давления на величину W не проявляется. В случае сжигания газового и жидкого топлива в двигателях влияние давления существенно.
возрастает, т.к. при сжатии газов возрастает концентрация. В большинстве случаев сжигание газового топлива производится при атмосферном давлении, поэтому влияние давления на величину W не проявляется. В случае сжигания газового и жидкого топлива в двигателях влияние давления существенно.
Катализаторы ускоряют протекание реакций. Как правило, для ускорения реакций горения используются металлы и их оксиды переходных периодов системы Д.И. Менделеева: хром, марганец, железо, кобальт, родий, осмий, платина и другие. Горение газов протекает достаточно быстро, поэтому при гомогенном горении катализаторы используются редко. В противоположность катализаторам есть вещества замедляющие протекание реакций – это ингибиторы.
1.4 Расчеты горения
Расчеты горения ведут по химическим уравнениям реакций, используя законы газового состояния: Бойля – Мариотта 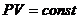 , Гей-Люссака
, Гей-Люссака 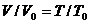 , Шарля
, Шарля 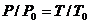 и Клапейрона – Менделеева
и Клапейрона – Менделеева 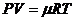 . Используется также закон Авогадро, согласно которому один грамм-моль любого газа при нормальных условиях (Т = 273 К, Р = 760 мм рт. ст.) занимает одинаковый объём – 22,4 дм3. Соответственно один кг-моль – 22,4 м3.
. Используется также закон Авогадро, согласно которому один грамм-моль любого газа при нормальных условиях (Т = 273 К, Р = 760 мм рт. ст.) занимает одинаковый объём – 22,4 дм3. Соответственно один кг-моль – 22,4 м3.
Рассмотрим реакцию горения водорода в кислороде: 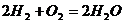 . Из уравнения следует, что при нормальных условиях для полного сгорания 2 × 22,4 = 44,8 м3 водорода требуется 22,4 м3 кислорода. Обычно для простоты и удобства расчеты ведут на один кубометр сжигаемого газа, т.е. для сгорания 1 м3 водорода требуется 0,5 м3 кислорода.
. Из уравнения следует, что при нормальных условиях для полного сгорания 2 × 22,4 = 44,8 м3 водорода требуется 22,4 м3 кислорода. Обычно для простоты и удобства расчеты ведут на один кубометр сжигаемого газа, т.е. для сгорания 1 м3 водорода требуется 0,5 м3 кислорода.
Рассмотрим реакцию горения метана в кислороде: 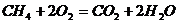 . Из уравнения следует, что для полного сгорания 22,4 м3 метана требуется 2 × 22,4 = 44,8 м3 кислорода. Следовательно, для сгорания 1 м3 метана необходимо 2 м3 кислорода.
. Из уравнения следует, что для полного сгорания 22,4 м3 метана требуется 2 × 22,4 = 44,8 м3 кислорода. Следовательно, для сгорания 1 м3 метана необходимо 2 м3 кислорода.
В практических условиях сжигание газа осуществляется в воздухе. Примем состав сухого воздуха: О2 – 21 %, N2 – 79%. Следовательно, 1 м3 кислорода содержится в 100/21 = 4,76 м3 воздуха. Или на 1 м3 кислорода приходится 3,76 м3 азота. Отсюда условная формула воздуха: (О2 + 3,76N2).
Запишем реакцию горения водорода в воздухе:
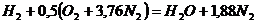 .
.
Из уравнения следует, что при нормальных условиях для полного сгорания 1 м3 водорода требуется 0,5 × 4,76 = 2,38 м3 воздуха. Таким образом, для сгорания 1 м3 водорода требуется 2,38 м3 воздуха. В результате образуются продукты сгорания: 1 м3 воды в виде пара и 1,88 м3 азота.
Запишем реакцию горения метана в воздухе:
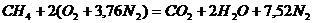 .
.
Из уравнения следует, что для полного сгорания 1 м3 метана необходимо 2 × 4,76 = 9,52 м3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м3 метана требуется 9,52 м3 сухого воздуха. Продукты сгорания содержат 1 м3 диоксида углерода, 2 м3 паров воды и 7,52 м3 азота.
Запишем реакцию горения пропана в воздухе:
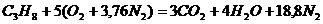 .
.
Из уравнения видно, что для полного сгорания 1 м3 пропана необходимо 5 × 4,76 = 23,8 м3 воздуха. Таким образом, при нормальных условиях для сгорания 1 м3 пропана требуется 23,8 м3 сухого воздуха.
Приведенные расчеты выполнены для стехиометрических уравнений и полученные соотношения воздуха и газа называются стехиометрическими. Например, для горения метана в воздухе стехиометрическое соотношение – 9,52. В реальных условиях воздуха может не хватать для полного сгорания газа или, напротив, воздух подается в избыточном количестве. Для характеристики реальных соотношений воздуха и газа в процессе горения введена безразмерная величина: коэффициент избытка воздуха (окислителя) – коэффициент α. Для стехиометрического соотношения α = 1. Если имеет место недостаток воздуха, то α < 1, а при избытке воздуха α > 1. Например, в процессе горения израсходовано 23 м3 воздуха и 2 м3 метана. Подсчитываем коэффициент α. Реальное соотношение воздуха и газа 23/2 = 11,5. Отсюда α = 11,5/9,52 = 1,2.
Выше показано, как можно подсчитывать необходимое количество воздуха для сгорания и определять объем продуктов сгорания для индивидуальных газов. Но обычно используемый газ – смесь различных газов. В этом случае расчет теоретически необходимого объема воздуха (воздуха сухого) ведется по формуле:
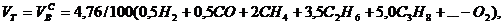 нм3/нм3, (4)
нм3/нм3, (4)
где 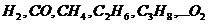 – соответственно объемное процентное содержание данных газов в исходной смеси.
– соответственно объемное процентное содержание данных газов в исходной смеси.
Используемый для сжигания атмосферный воздух содержит влагу, поэтому расчет объема влажного воздуха производят по формуле:
 нм3/нм3, (5)
нм3/нм3, (5)
где 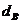 – влагосодержание воздуха, г/нм3;
– влагосодержание воздуха, г/нм3;
0,00124 – объем 1 г водяного пара.
И, наконец, определяется объем воздуха действительный с учетом величины коэффициента α по формуле:
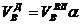 . (6)
. (6)
Пример. Имеется газ состава СН4 – 95%, С3Н8 – 5%. Определить объем воздуха действительного для сжигания данного газа при α = 1,1 и 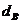 = 10 г/м3.
= 10 г/м3.
Производим расчеты:
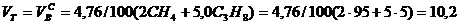 , нм3/нм3,
, нм3/нм3,
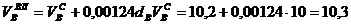 , нм3/нм3,
, нм3/нм3,
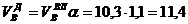 , нм3/нм3.
, нм3/нм3.
Объем продуктов сгорания газовой смеси определяется по следующим формулам.
Объем диоксида углерода
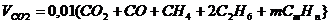 , нм3/нм3. (7)
, нм3/нм3. (7)
Объем водяных паров
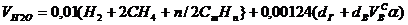 , нм3/нм3. (8)
, нм3/нм3. (8)
Объем азота
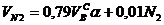 , нм3/нм3. (9)
, нм3/нм3. (9)
где N 2 – процентное содержание азота в газовой смеси.
Объем кислорода
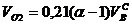 , нм3/нм3. (10)
, нм3/нм3. (10)
Суммарный объем продуктов сгорания
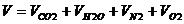 , нм3/нм3. (11)
, нм3/нм3. (11)
1.5 Цепной механизм процесса горения
Химические уравнения реакций горения газов, рассмотренные выше, не вскрывают механизм реакций, а являются лишь уравнениями итогового баланса. Процесс горения сложный физико-химический процесс, скорость которого определяется интенсивностью физических и химических явлений и особенностями их взаимодействия. Горение – многофакторный процесс, включающий химическую кинетику, термодинамику, тепломассоперенос, газо- и гидродинамику течений. Основной вклад в создании современных представлений о механизме реакций горения внесли академик Н.Н. Семёнов и его школа. За разработку теории цепных реакций Н.Н. Семёнову и английскому учёному С.Н. Хиншелвуду была присуждена Нобелевская премия.
Согласно теории цепных реакций горение протекает в виде разветвлённых и неразветвлённых цепей, состоящих из элементарных актов превращений. В цепной реакции участвуют радикалы, атомы и другие неустойчивые промежуточные соединения. Цепь начинается с активного центра, который в конце каждого звена регенерируется (восстанавливается). В качестве активных центров выступают радикалы. Радикал – атом, молекула или осколок молекулы, имеющие на внешней электронной оболочке неспаренные электрон или электроны (ненасыщенные валентности). Обозначение радикалов: водорода – Н, кислорода – О, гидроксил – ОН, метил – СН3, метилен – СН2, метин – СН, формин – НСО и т.д. Радикалы чрезвычайно химически активны и очень быстро вступают во взаимодействие.
Наиболее изученным является механизм горения водорода в кислороде. Зарождение цепи начинается с эндотермического процесса образования активных центров – радикалов водорода:
Н2 + М = Н + Н + М.
Элемент М следует понимать как источник энергии активации. Это может быть открытое пламя, раскаленное тело, электрическая искра и т.п.
Звено превращений состоит из следующих элементарных актов:
 Н + О2 → ОН + Н2 → → Н
Н + О2 → ОН + Н2 → → Н
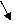 Н2О
Н2О
 О + Н2 → → → Н
О + Н2 → → → Н
 ОН + Н2 → Н
ОН + Н2 → Н
Н2О
Итогом единичного звена является реакция:
Н + 3Н2 +О2 = 2Н2О +3Н.
Радикал водорода приводит к образованию двух молекул воды и трех новых радикалов. Каждый из них может привести к развитию цепи превращений. Такая цепная реакция называется разветвленной. Однако в процессе горения могут быть как, благоприятные реакции (соударения), так и неблагоприятные. Например, Н + Н = Н2 . Практика показывает, что число благоприятных реакций превышает число неблагоприятных. Поэтому воспламенение ГВС приводит к быстрому распространению горения на весь объем, что в итоге приводит к взрыву смеси.
Механизм горения метана представляет собой довольно сложную совокупность цепных реакций с образованием на отдельных стадиях стабильных и нестабильных промежуточных продуктов. Предполагаемый механизм цепного горения метана в кислороде при стехиометрическом соотношении следующий:
1. Н + О2 → ОН + О
СН4 + ОН → СН3 + Н2О
СН4 + О → СН3 + ОН→ СН2 + Н2О
2. СН3 + О2 → НСНО + ОН
СН2 + О2 → НСНО + О
3. НСНО + ОН → НСО + Н2О
НСО + О2 → СО + О + ОН
НСНО + О → СО + Н2О
4. СО + О2 → СО2
СО + ОН → СО2 + Н
Итог звена реакции горения метана в кислороде:
Н + 2СН4 + 4О2 = 2СО2 + 4Н2О + Н.
Ещё более сложный механизм горения метана в воздухе, особенно при отклонении от стехиометрического соотношения.
1.6 Температура горения газов
Различают следующие температуры горения газов: калориметрическая, теоретическая и действительная.
Калориметрическая температура – это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха. Калориметрическая температура может быть рассчитана по формуле:
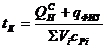 , (12)
, (12)
где 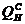 – низшая теплота сгорания газа;
– низшая теплота сгорания газа;
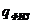 – теплосодержание воздуха и газа;
– теплосодержание воздуха и газа;
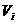 – объем i-го компонента продуктов сгорания газов;
– объем i-го компонента продуктов сгорания газов;
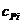 – теплоемкость i-го компонента продуктов сгорания газов.
– теплоемкость i-го компонента продуктов сгорания газов.
Теплосодержание (энтальпия) воздуха и газа вычисляются по формуле:
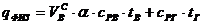 ,
,
где 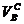 – объем воздуха сухого, необходимый для полного сжигания газа;
– объем воздуха сухого, необходимый для полного сжигания газа;
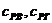 – теплоемкость воздуха и газа;
– теплоемкость воздуха и газа;
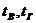 – температура воздуха и газа.
– температура воздуха и газа.
Знаменатель формулы 12 в развернутом виде
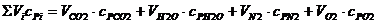 .
.
Теплоемкость продуктов сгорания величина не постоянная и увеличивается с повышением температуры, поэтому калориметрическая температура рассчитывается методом итераций (последовательных приближений). Примерные значения калориметрической температуры некоторых газов при сжигании в сухом воздухе при нормальных условиях и коэффициенте α = 1 приведены в таблице 1.2.
Таблица 1.2. Калориметрическая температура горения газов
| Наименование газа | Температура, °С |
| Водород | |
| Метан | |
| Пропан | |
| Ацетилен | |
| Природный газ | |
| Доменный газ | |
| Сжиженный газ |
С увеличением влажности воздуха температура снижается на 25 – 20 градусов на каждый весовой процент влаги. К снижению температуры приводит уменьшение и увеличение коэффициент α относительно α = 1.
Теоретическая температура – это температура продуктов сгорания горючих газов в адиабатических условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Реакции диссоциации – распад молекул продуктов сгорания под воздействием высокой температуры. Например:
Н2О ↔ Н2 + 0,5О2 – 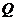 ;
;
СО2 ↔ СО + 0,5О2 – 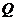 .
.
При протекании реакций диссоциации теплота поглощается и в результате температура горения снижается. Теоретическая температура рассчитывается по формуле:
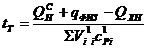 , (13)
, (13)
где 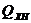 – химическая неполнота сгорания, включая потери теплоты на
– химическая неполнота сгорания, включая потери теплоты на
диссоциацию продуктов сгорания;
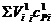 – сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
– сумма произведений объемов и средних теплоемкостей с учетом диссоциации на 1 м3 газа.
Степень диссоциации определяется по константам диссоциации для каждой реакции. До температуры 1500°С диссоциацию можно не учитывать.
Действительная температура – это температура продуктов сгорания горючих газов в действительных условиях с действительным значением коэффициентом α с действительной температурой газа и воздуха с учетом химической неполноты сгорания и реакций диссоциации. Действительные условия отличаются от адиабатических условий, т.к. всегда есть потери теплоты в окружающую среду.
Действительная температура находится по формуле:
 , (14)
, (14)
где 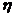 – пирометрический коэффициент.
– пирометрический коэффициент.
Величина пирометрического коэффициента зависит от печей и их тепловой изоляции. Принимается в пределах от 0,5 до 0,85.
1.7 Температура воспламенения
Процесс возбуждения горения называется воспламенением. Под температурой воспламенения (самовоспламенения) понимается минимальная температура, до которой должна быть нагрета газовоздушная смесь, чтобы начался самопроизвольный процесс горения не требующий больше внешнего подводы теплоты. Тепловое воспламенение носит цепной характер и может заканчиваться взрывом. Температура воспламенения определяется экспериментально. Величина температуры воспламенения зависит от природы газа, от содержания газа в газовоздушной смеси, от давления и других факторов. Температура воспламенения горючих газов в смеси с кислородом всегда меньше, чем в смеси с воздухом. Введение в смесь негорючих (балластных) газов (N2, CO2 и т.п.) приводит к повышению температуры воспламенения. Минимальные значения температуры воспламенения газовоздушных смесей приведены в таблице 1.3.
Таблица 1.3. Минимальная температура воспламенения газовоздушных смесей
| Газ | Температура воспламенения, °С | Газ | Температура воспламенения, °С |
| Водород | Бутан | ||
| Метан | Оксид углерода | ||
| Пропан | Природный газ |
В действительности воспламенение газовоздушной смеси производится зажиганием (вынужденное зажигание). Зажигание или поджигание характеризуется тем, что холодная газовоздушная смесь воспламеняется в одном месте (пламенем спички, раскаленным телом, искрой) и возникшее пламя распространяется по всему объему газовоздушной смеси. Таким образом, зажигание смеси отличается от теплового воспламенения тем, что смесь доводится до температуры воспламенения не во всем объеме одновременно, а только в малой части объема, откуда горение распространяется на весь объем холодной смеси.
1.8 Пределы воспламенения
Смеси горючих газов с воздухом или кислородом воспламеняются и горят только в определенных концентрационных пределах. Различают нижний и верхний пределы воспламенения. Нижний предел соответствует минимальному, а верхний предел – максимальному содержанию газа в газовоздушной смеси при котором происходит воспламенение при зажигании и самопроизвольное распространение пламени. Вне концентрационных пределов газовоздушные смеси не горят и не взрываются. Существование пределов воспламенения объясняется тепловыми потерями при горении. В таблице 1.4 приведены пределы воспламенения газов в смеси с воздухом при 20°С и давлении 760 мм рт. ст.
Таблица 1.4. Концентрационные пределы воспламенения
| Наименование газа | Содержание газа в смеси, % объема | ||
| На пределах воспламенения | При α = 1 | ||
| Нижний | Верхний | ||
| Водород | 4,0 | 75,0 | 29,5 |
| Метан | 5,0 | 15,0 | 9,5 |
| Этан | 3,0 | 12,5 | 5,7 |
| Пропан | 2,2 | 9,5 | 4,0 |
| Бутан | 1,9 | 6,1 | 3,1 |
| Ацетилен | 2,5 | 81,0 | 7,8 |
| Оксид углерода | 12,5 | 74,0 | 29,5 |
| Сжиженный газ | ≈ 2 | ≈ 10 | 3 ÷ 4 |
С увеличением температуры газовоздушной смеси пределы воспламенения расширяются, и температурах, превышающих температуру воспламенения, смеси горят при любом объемном соотношении воздуха и газа.
Пределы воспламенения смеси газов определяются по правилу аддитивности:
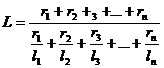 , (15)
, (15)
где 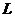 – нижний или верхний предел воспламенения смеси газов, % объема;
– нижний или верхний предел воспламенения смеси газов, % объема;
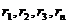 – содержание отдельных компонентов в смеси газов в объемных
– содержание отдельных компонентов в смеси газов в объемных
долях или процентах;
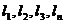 – нижние или верхние пределы воспламенения отдельных
– нижние или верхние пределы воспламенения отдельных
компонентов в газовоздушной смеси, % объема.
Величина коэффициента α на пределах воспламенения для смеси газов рассчитывается по формуле:
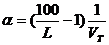 . (16)
. (16)
Расчет по формуле 16 для метановоздушной смеси дает α = 0,6 на верхнем пределе и α = 2,0 на нижнем пределе.
1.9 Нормальное распространение пламени
Пламенем называется зона, в которой протекают реакции горения. Характерным свойством пламени является его свечение. Пламя, возникшее в объеме или в потоке газовоздушной смеси (ГВС), отделяет еще несгоревшую смесь от продуктов горения. Проделаем мысленный эксперимент (рис. 1). Возьмем прозрачную трубку, открытую с одного торца. Заполним трубку газовоздушной смесью (в пределах воспламенения) и воспламеним смесь у открытого торца. Возникнет пламя, которое будет перемещаться вдоль трубки. Продукты сгорания свободно истекают из открытого торца трубки.

Рис. 1. Мысленный эксперимент
Перемещение пламени вызывается тем, что ГВС перед ним нагревается до температуры воспламенения за счет теплоты, поступающей из пламени, теплопроводностью и диффузией раскаленных продуктов сгорания и радикалов. Линейная скорость, с которой перемещается пламя (фронт горения) по однородной ГВС называется равномерной скоростью распространения пламени (v, м/с). Величина равномерной скорости распространения пламени зависит от физико-химических констант ГВС и от формы фронта горения (диаметра трубки). С увеличением диаметра трубки равномерная скорость увеличивается, т.к. фронт горения искривляется, усиливаются завихрения и конвективные потоки. С уменьшением диаметра трубки равномерная скорость распространения пламенизамедляется и при каком-то значении диаметра процесс горения становится невозможным. Это объясняется тем, что с уменьшением размеров трубки (канала) возрастает отношение периметра к площади сечения. Теплопотери в окружающую среду превышают теплопоступления из объема пламени – горение прекращается. Это наглядно показано на рис. 2.
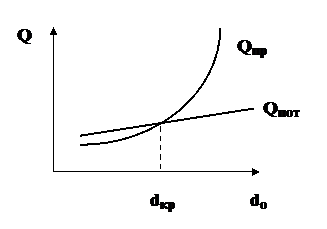
Рис. 2. Зависимость прихода теплоты Qпр и теплопотерь Qпот от
диаметра трубки (канала)
Диаметр, меньше которого горение невозможно, называется критическим диаметром. Впервые наличие критического диметра установил английский ученый Гемфри Дэви в 1815 году. Исследуя возможность предотвращения взрывов метана в угольных шахтах, он ограждал пламя открытых светильников различными сетками. Оказалось, что при размерах ячейки сетки меньше некоторого значения, пламя не проскакивает через сетку. Особенно эффективными оказались медные сетки. В результате была предложена взрывобезопасная шахтерская лампа (лампа Дэви). Горючий газ попадая через сетку внутрь лампы воспламенялся, но горение не распространялось наружу и не вызывало взрыв газовоздушной смеси. Величина критического диаметра для стехиометрических смесей газов с воздухом составляет: метан – 3,5 мм, водород – 0,9 мм. Сейчас огнепреградительные сетки используются в системах отвода дымовых газов и вентиляции опасных производств.
Для сравнения горючих свойств газов, независимо от диаметра трубки, введено понятие нормальная скорость распространения пламени. Нормальной скоростью распространения пламени (UН , м/с) называется скорость, с которой пламя перемещается по нормали к поверхности фронта горения. Нормальная скорость распространения пламени зависит только от физико-химических констант ГВС и находится по формуле:

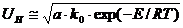 , (17)
, (17)
где 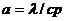 – коэффициент температуропроводности ГВС.
– коэффициент температуропроводности ГВС.
Здесь λ – коэффициент теплопроводности, с – теплоемкость и
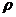 – плотность ГВС.
– плотность ГВС.
Величина нормальной скорости распространения пламени зависит от природы горючего газа и состава ГВС, т.е. от коэффициента α. На рис. 3 показана зависимость нормальной скорости от коэффициента α для метановоздушной смеси.
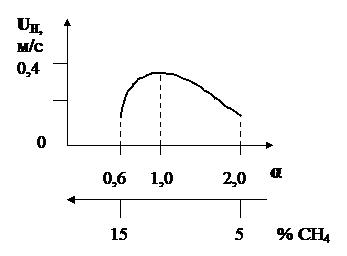
Рис. 3. Зависимость нормальной скорости от коэффициента α
для метановоздушной смеси
Из рис. 3 следует, что величина нормальной скорости возрастает с увеличением коэффициента α, достигает максимума при α ≈ 0,9 а, затем уменьшается. Наглядно видна зона устойчивого воспламенения и горения, которая находится в диапазоне α = 0,6 ÷ 2,0, или от 5% до 15% содержания метана в ГВС.
Значения максимальной нормальной скорости для чистых газов в смеси с воздухом: метан – 0,37 м/с, пропан – 0,38 м/с, водород – 2,7 м/с.
Скорость распространения пламени в смеси с кислородом всегда выше.
1.10 Экспериментальное определение нормальной скорости
распространения пламени
По формуле 17 величина нормальной скорости распространения пламени находится аналитически исходя из физико-химических констант смеси. Однако зачастую эти константы неизвестны, поэтому UН определяют экспериментально. Для эксперимента используется лабораторная горелка Бунзена или Тэклю (рис. 3).
Горелка Бунзена – изобретение Роберта Бунзена (1855). Горелка имеет круглое основание – 1, смеситель (инжектор) – 3 в виде металлической трубки, в нижней части которой имеются отверстия для поступления воздуха и регулятор расхода воздуха – 2. Газ подводится с боку из газопровода.
При работе горелки газ в виде струи с большой скоростью выходит из сопла, создавая разрежение в смесителе. Благодаря этому разрежению, окружающий воздух засасывается (инжектируется) в смеситель и при движении вверх смешивается с газом, образуя горючую смесь, которая поджигается на выходе из устья горелки.
Горелка Тэклю – изобретение Николая Тэклю (1890) – имеет аналогичное устройство с горелкой Бунзена. Только у горелки Тэклю нижняя часть смесителя расширена. Воздух поступает в щель между расширенной частью смесителя и диском – 2, вращением которого изменяют ширину щели, уменьшая или увеличивая приток воздуха.
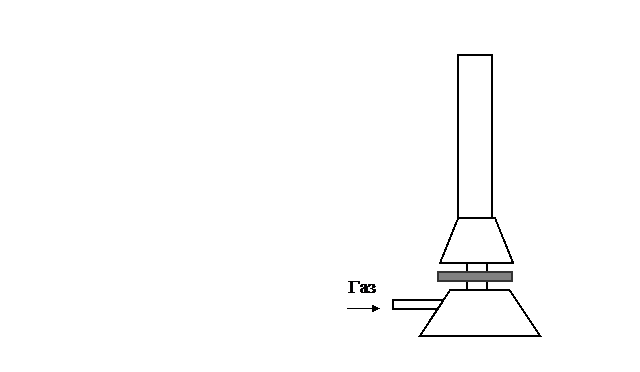
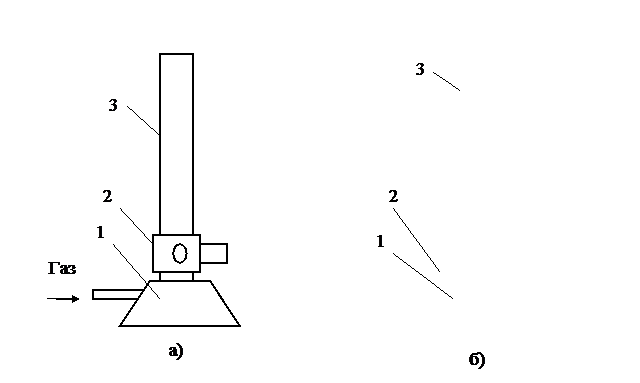
Рис. 3. Лабораторные горелки: а) Бунзена, б) Тэклю:
1 – основание; 2 – регулятор расхода воздуха; 3 – смеситель
Пламя лабораторной горелки имеет два фронта горения. Внутренний фронт – горение происходит за счет первичного воздуха (α < 1). И внешний – где происходит догорание за счет кислорода окружающего воздуха. На рис. 4 показано устье горелки и структура пламени.
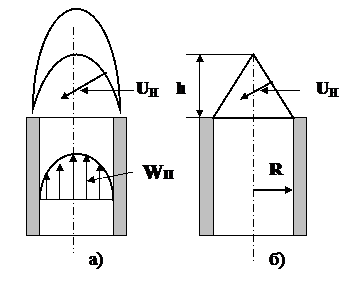
Рис. 4. Вид и структура пламени горелки
Внутренний фронт горения имеет форму близкую к форме конуса. Это объясняется тем, что поле скоростей потока ГВС (Wп) имеет параболический профиль (рис. 4а). Максимальная скорость потока наблюдается по оси горелки и минимальная – на периферии, т.е. у внутренней стенки смесителя.
Примем, что внутренний фронт горения имеет форму правильного конуса и основание конуса равно диаметру устья горелки, а его высота – h (рис. 4б). Следовательно, образующая конуса 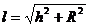 . Количество смеси, истекающей из устья горелки:
. Количество смеси, истекающей из устья горелки:
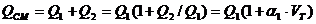 ,
,
где 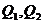 – соответственно расход газа и воздуха;
– соответственно расход газа и воздуха;
α1 – коэффициент избытка первичного воздуха;
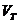 – расход воздуха теоретический.
– расход воздуха теоретический.
Горение происходит на боковой поверхности конуса, отсюда количество сгорающей смеси:
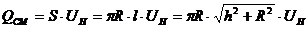 ,
,
где S – площадь боковой поверхности конуса.
Поскольку количество истекающей и сгорающей смеси одинаково, то приравнивая эти выражения получаем:
 . (18)
. (18)
Все величины, входящие в формулу 18 находятся экспериментально.
1.11 Устойчивость пламени
Под устойчивостью пламени (горения) понимается его способность противостоять отрыву и проскоку. Отрыв пламени – это отход пламени от устья горелки и последующее его погасание. Проскок пламени – проникновение пламени внутрь горелки. При этом пламя гаснет или горение продолжается внутри горелки с образование токсичных веществ и может привести к расплавлению горелки. Отрыв и проскок пламени, нежелательные явления, т.к. приводя к возникновению опасных ситуаций.
При правильной организации процесса горения фронт пламени устанавливается или стабилизируется в той части пространства, где скорость движения потока ГВС равна (компенсируется) встречной скоростью движения фронта воспламенения. Обратимся снова к пламени лабораторной горелки. На рис. 5 показан внутренний конусный фронт горения и построен параллелограмм скоростей на его поверхности.
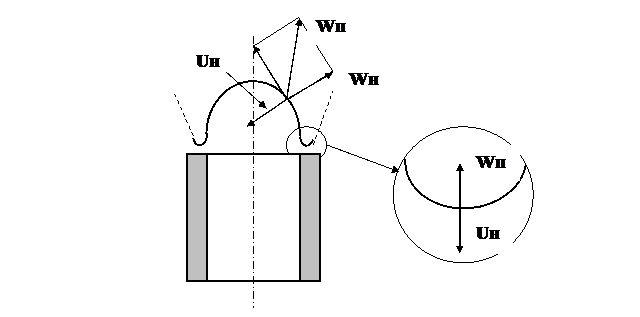
Рис. 5. Устойчивость пламени
Из рис. 5 следует, что Uн компенсируется только нормальной составляющей скорости потока – Wн. На поверхности конусного фронта Wп > Uн. Это означает, что конусный фронт неустойчивый, т.к. пламя сносится по поверхности конуса к вершине. В действительности пламя горелки устойчивое вследствие того, что у основания конуса фронт горения разворачивается в горизонтальную плоскость и образуется кольцевой зажигающий пояс. В зажигающем поясе скорость потока и скорость горения равны, поэтому зажигающий пояс устойчив и воспламеняет поток ГВС, выходящей из устья горелки. С увеличением Wн зажигающий пояс несколько отходит от устья. При этом Uн в зажигающем возрастает, т.к. уменьшается охлаждающее воздействие на пламя устья. И вновь происходит их взаимная компенсация: Wн = Uн. Однако при дальнейшем увеличение Wн может наступить момент, когда Wн превысит Uн. В этом случае происходит отрыв и погасание пламени.
| <== предыдущая | | | следующая ==> |
| Основи і основні поняття корпорації та КІС | | |
Date: 2015-07-22; view: 5980; Нарушение авторских прав