
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Приготовление растворов индикаторов
|
|
Таблица 1
Понятие о химическом анализе
| Химический анализ – это установление химического состава веществ опытным путем | ||||
| 
| 
| ||
| Метод анализа – это теоретически обоснованный способ проведения анализа с определением принципов, положенных в его основу | Методика анализа – это подробное описание всех этапов и условий проведения анализа | |||
| Оценка результатов Анализа проводится с помощью аппарата метрологии | ||||
Стадии анализа химического вещества как процесс получения информации Таблица 2
| Источник информации | Предварительное преобразование | 
|  Кодирование сигналов Кодирование сигналов
|  Декодирование сигналов Декодирование сигналов
| 
|   Получение информации Получение информации
| Оценка результатов | 
| ||||
| 
| 
| 
| Оценки качества с/х продукции, объектов окружающей среды, почв, поверхностных вод и атмосферного воздуха | ||||||||
| Анализируемый объект | Отбор средней пробы | 
| ||||||||||

| ||||||||||||
| Получение оптимальной аналитической формы (растворение, разделение, прокаливание и т.д.) | 
| Проведение химической реакции, наблюдение, измерение | 
| Построение калибровочных графиков, сравнение со стандартным образцом и т. д. | 
|  Расчеты значения содержания определяемого компонента Расчеты значения содержания определяемого компонента
| Математическая обработка результатов анализа |
Таблица 3
Растворимость и произведение растворимости некоторых электролитов при (18 – 25оС)
| Формула вещества | Растворимость, моль/л | Произведение растворимости |
| ВаСО3 | 8,9 × 10-5 | [Ва2+][СО3] = 8 × 10-9 |
| ВаSО4 | 1,0 × 10-5 | [Ва2+][SО42-] = 1,1 × 10-10 |
| SrSО4 | 5,3 × 10-4 | [Sr2+][SО42-] = 2,8 × 10-7 |
| SrСО3 | 4,0 × 10-5 | [Sr2+][СО3] = 1,6 × 10-9 |
| CаSО4 | 7,8 × 10-3 | [Cа2+][SО42-] = 6,1 × 10-5 |
| CаСО3 | 6,9 × 10-5 | [Cа2+][СО3] = 4,8 × 10-9 |
| Fe (OH)2 | 4,9 × 10-6 | [Fe2+][OH-]2 = 4,8 × 10-16 |
| Fe (OH)3 | 1,9 × 10-10 | [Fe3+][OH-]3 = 3,8 × 10-38 |
| Zn (OH)2 | 1,4 × 10-6 | [Zn2+][OH-]2 = 1,0 × 10-17 |
| ZnS | 3,5 × 10-12 | [Zn2+][S2-] = 1,2 × 10-23 |
| AgCl | 1,25 × 10-5 | [Ag+][Cl-] = 1,56 × 10-10 |
| AgBr | 8,8 × 10-7 | [Ag+][Br-] = 7,7 × 10-13 |
| PbCl2 | 3,9 × 10-2 | [Pb2+][Cl-] = 2,4 × 10-4 |
| PbSO4 | 1,5 × 10-4 | [Pb2+][SO42-] = 2,2 × 10-8 |
Таблица 4.
Константы диссоциации некоторых слабых электролитов (при 25оС)
| Электролит | Константа диссоциации |
| Вода | К =  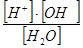 = 1,8 × 10-16 = 1,8 × 10-16
|
| Гидроксид аммония | К = 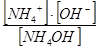 = 1,79 × 10-5 = 1,79 × 10-5
|
| Азотистая кислота | К = 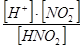 = 4,0 × 10-4 = 4,0 × 10-4
|
| Сернистая кислота | К1 = 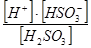 = 1,3 × 10-2
К2 = = 1,3 × 10-2
К2 = 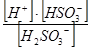 = 6 × 10-8 = 6 × 10-8
|
| Сероводородная кислота | К1 = 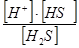 = 8,9 × 10-8
К2 = = 8,9 × 10-8
К2 = 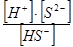 = 1,3 × 10-13 = 1,3 × 10-13
|
| Угольная кислота | К1 = 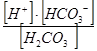 = 4,31× 10-7
К2 = = 4,31× 10-7
К2 = 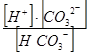 = 5,61× 10-11 = 5,61× 10-11
|
| Фосфорная ортокислота | К1 = 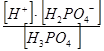 = 7,51× 10-3
К2 = = 7,51× 10-3
К2 = 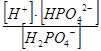 = 6,23× 10-8
К3 = = 6,23× 10-8
К3 = 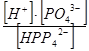 = 2,2× 10-13 = 2,2× 10-13
|
| Уксусная кислота | К = 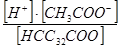 = 1,86× 10-5 = 1,86× 10-5
|
Таблица 5
Приготовление растворов индикаторов
| Индикаторы | Область перехода (интервал рН) | Окраска | Способ приготовления | |
| кислотной формы | щелочной формы | |||
| Метиловый оранжевый, раствор с массовой долей 0,1% | 3,1-4,4 | Розовая | Оранжево-желтая | 0,1 г индикатора растворяют в 100 см3 воды |
| Метиловый красный, раствор с массовой долей 0,1% | 4,4-6,2 | Красная | Желтая | 0,1 г индикатора растворяют в 100 см3 этанола |
| Лакмус (азолитмин), раствор с массовой долей 0,5% | 5,0-8,0 | Красная | Синяя | 0,5 г индикатора растворяют в 100 см3 воды |
| Фенолфталеин, с массовой долей 0,1% | 8,0-10,0 | Бесцветная | Красная | 0,1 г индикатора растворяют в 100 см3 этанола |
| Фенолфталеин красный, с массовой долей 0,1% | 6,8-8,0 | Желтая | Красная | 0,1 г индикатора растворяют в 100 см3 этанола с массовой долей С2Н5ОН 25% |
| Тимолфталеин, раствор с массовой долей 0,5% | 9,3-10,5 | Бесцветная | Синяя | 0,5 г индикатора растворяют в 100 см3 этанола |
| Универсальный индикатор (по Кольтгофу) | 2,0-10,0 | ¾ | ¾ | Смешивают этанольные растворы индикаторов с массовой долей 0,1% в следующих объемах: диметиламинобензола 15 см3; бромтимолового синего 20 см3; метилового красного 5 см3; фенолфталеина 20 см3; тимолфталеина 20 см3 |
ОСНОВНАЯ ЛИТЕРАТУРА
1. Основы аналитической химии. Кн.1. Общие вопросы. Методы разделения.: Учебник для вузов/Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. Под редакцией Ю.А.Золотова.- М.: Высшая школа, 2000.- 495 с.
2. Основы аналитической химии. Кн.2. Методы химического анализа: Учебник для вузов / Ю.А.Золотов, Е.Н.Дорохова, В.И.Фадеева и др. Под редакцией Ю.А.Золотова.- М.: Высшая школа; 2000. - 494 с.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
1. И.К.Цитович Курс аналитической химии: Учебник для с.-х. вузов.- М.: Высшая школа; 1994.
2. В.И.Посыпайко, Н.А.Козырева, Ю.П.Логачева. Химические методы анализа.: М.: Высшая школа; 1989.-
3. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для вузов. /Ю.А.Ершов, В.А.Попков, А.С.Берлянд, А.З.Книжник; под редакцией Ю.А.Ершова.- М.: Высшая школа, 2000.- 560с: ил.
4. Основы аналитической химии. Практическое руководство: Учебное пособие для вузов /Под редакцией Ю.А.Золотова.- М.: Высшая школа, 2001.- 463 с.; ил.
5. Р.К.Чернова, Е.Г.Кулапина, Г.М.Белолипцева Практикум по аналитической химии: Учебное пособие /Под редакцией Р.К.Черновой.- Саратов: Изд-во Саратовского университета, 1997. ч.1.-180 с.: ил.
6. Р.К.Чернова, Г.М.Белолипцева, Л.М.Козлова Практикум по аналитической химии: Учебное пособие /под редакцией Р.К.Черновой.- Саратов: Изд-во Саратовского университета, 1999.- ч.2.-169 с.: ил.
7. С.Н.Штыков, Т.Д.Смирнова Методы анализа вод: Учебное пособие.- Саратов: Изд-во Саратовского университета, 1992.- 115 с.
8. Практикум по хранению и технологии сельскохозяйственных продуктов. /В.Н.Курдина, Б.А.Карпов, Н.М.Личко и др., под редакцией Л.А.Трисвятского/ Ученое пособие для высших с.-х. учебных заведений.- М. «Колос», 1981.- 190 с.: ил.
9. Основы аналитической химии. Практическое руководство: Учебное пособие для вузов под общ. Редакцией Ю.А.Золотова.- М.: Высшая школа,2001.- 463 с.: ил.
10. К.Дерффель. Статистика в аналитической химии.- М. Мир, 1994.-268 с.
11. Здешнева Г.Ф., Сидорская Э.А. Программированные задания по аналитической химии: Уч. пособие для биолог. фак. пед. институтов.- М.,: Просвящение.-1986.- 80 с.
12. Задачник по аналитической химии. Титриметрические методы анализа: Учебное пособие /Я.И.Коренман, П.Т.Суханов, С.П.Калинкина;/ Воронежская государственная технологическая академия Воронеж. 2001.- 336с
Содержание
Стр
Date: 2015-06-11; view: 1685; Нарушение авторских прав