
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

ВВЕДЕНИЕ. Методические указания
Методические указания
По Контрольно-курсовой работе
по дисциплине
ТЕРМОДИНАМИКА
Направление подготовки: 15.03.01 Машиностроение
Профиль подготовки: Машины и технология литейного производства
Форма обучения: очная
Тула 2014 г.
Методические указания по ККР составлены доцентом П.И. Маленко и утверждены на заседании кафедры СЛиТКМ механико-технологического факультета
протокол №_1 от "_30__" _августа_ 20 12 г.
Зав. кафедрой ___  _____ А.А. Протопопов
_____ А.А. Протопопов
Методические указания по ККР пересмотрены и утверждены на заседании кафедры СЛиТКМ механико-технологического факультета
протокол №_1 от "_29__" _августа_ 20 14 г.
Зав. кафедрой ___  _____ А.А. Протопопов
_____ А.А. Протопопов
ВВЕДЕНИЕ
Большинство физико-химических процессов и реакций в литейном производстве осуществляется при постоянном давлении (~0,1МН/м2). Направление процесса (реакции) при заданной температуре определяется знаком изменения энергии Гиббса этого процесса. При отрицательном значении  процесс протекает в сторону образования конечных веществ, при положительном значении
процесс протекает в сторону образования конечных веществ, при положительном значении  - в сторону образования исходных веществ. При нулевом значении изменения энергии Гиббса (
- в сторону образования исходных веществ. При нулевом значении изменения энергии Гиббса ( =0) достигается динамическое равновесие процесса, т.е. процесс (реакция) идет одновременно в двух противоположных направлениях с одинаковой скоростью.
=0) достигается динамическое равновесие процесса, т.е. процесс (реакция) идет одновременно в двух противоположных направлениях с одинаковой скоростью.
Полнота протекания процесса (реакции) в изобарно изотермических условиях, т.е. при р=const и Т=const. Определяется нахождением мольных долей конечных веществ из уравнения, составленного на основании торжества рассчитанного значения константы равновесия Кр и значений константы равновесия КN, выраженной через отношения мольных долей конечных веществ к мольным далям исходных веществ (мольные доли веществ подставляются в выражение КN в степенях, соответствующих стехиометрическим коэффициентным этих веществ в реакции).
Методическое пособие по ККР составлено на примере гетерогенной реакции Mg+H2O=MgO+H2 при 1000 К.
1. ВЫБОР ИСХОДНЫХ ТЕПЛОФИЗИЧЕСКИХ ДАННЫХ ДЛЯ ВЕЩЕСТВ РЕАКЦИИ
Выбор исходных теплофизических данных для исходных и конечных веществ реакции производится по справочникам [1, 2, 3] с переводом кал в Дж (1 кал=4,184 Дж).
Для гетерогенной реакции Mg+H2O=MgO+H2 (1) исходные теплофизические данные для исходных и конечных веществ занесены в табл.1.
Таблица 1.
Исходные теплофизические данные для веществ реакции Mg+H2O=MgO+H2
| Вещество |  , Дж/
моль , Дж/
моль
|  , Дж/
(моль) , Дж/
(моль)
| Тпр, К |  , Дж/
моль , Дж/
моль
| Тпл, К |  , Дж/
моль , Дж/
моль
| Ткип, К |  , Дж/
моль , Дж/
моль
|
| Mg | 32,5 | - | - | 8493,5 | ||||
| H2O | -285830 | 69,9 | - | - | ||||
| MgO | -601241 | 27,4 | - | - | (3533) | |||
| H2 | 130,6 | - | - | 57,6 | 20,6 |
Выбираем [1, 2] уравнения мольной изобарной теплоемкости исходных и конечных веществ реакции в температурном интервале от 298 К до заданной температуры. Эти уравнения необходимы для определения  и
и  веществ при заданной температуре Т.
веществ при заданной температуре Т.
Для реакции Mg+H2O=MgO+H2 при 1000 К эти уравнения следующие:
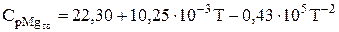 , Дж/(моль.К) [293-923плК];
, Дж/(моль.К) [293-923плК];
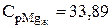 , Дж/(моль.К) [923-1130 К];
, Дж/(моль.К) [923-1130 К];
 , Дж/(моль.К) [273-373 К];
, Дж/(моль.К) [273-373 К];
 , Дж/(моль.К) [298-2500К];
, Дж/(моль.К) [298-2500К];
 , Дж/(моль.К) [298-3098плК];
, Дж/(моль.К) [298-3098плК];
 , Дж/(моль.К) [298-3000К].
, Дж/(моль.К) [298-3000К].
2. ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ РЕАКЦИИ ПРИ ЗАДАННОЙ ТЕМПЕРАТУРЕ
Для определения  реакции при заданной температуре Т вначале необходимо по выбранным значениям
реакции при заданной температуре Т вначале необходимо по выбранным значениям  , уравнениям теплоемкости
, уравнениям теплоемкости  ,
,  ,
,  рассчитать для этой же температуры Т.
рассчитать для этой же температуры Т.
Применительно к уравнению (1):


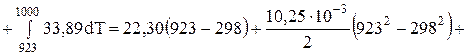
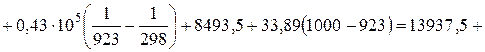
 Дж/моль;
Дж/моль;





 Дж/моль.
Дж/моль.


 Дж/моль.
Дж/моль.

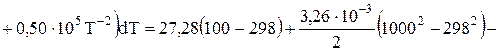
 Дж/моль.
Дж/моль.
Изменение энтальпии реакции при заданной температуре Т определяют по уравнению:
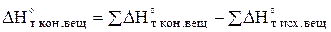 , (2)
, (2)
где 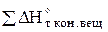 - алгебраическая сумма энтальпии конечных веществ в реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/моль;
- алгебраическая сумма энтальпии конечных веществ в реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/моль;
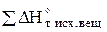 - алгебраическая сумма энтальпии исходных веществ реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/моль.
- алгебраическая сумма энтальпии исходных веществ реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/моль.
Для (1) изменение энтальпии реакции при 1000 К будет равно:


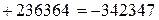 Дж/моль.
Дж/моль.
 Дж/моль.
Дж/моль.
3. ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ РЕАКЦИИ ПРИ ЗАДАННОЙ ТЕМПЕРАТУРЕ
Так же, как и для определения 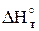 реакции, вначале по выбранным значениям
реакции, вначале по выбранным значениям 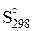 , уравнениям теплоемкости,
, уравнениям теплоемкости,  ,
,  ,
, 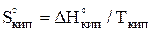 необходимо рассчитать энтропию каждого вещества реакции для заданной температуры.
необходимо рассчитать энтропию каждого вещества реакции для заданной температуры.
Применительно к (1):
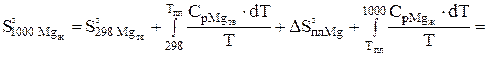



 (Дж/моль*К);
(Дж/моль*К);

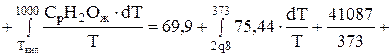
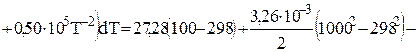

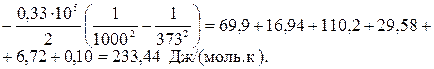


 Дж/(моль*К);
Дж/(моль*К);



 Дж/(моль*К).
Дж/(моль*К).
Изменение энтропии реакции при заданной температуре Т определяют по уравнению:
 , (3)
, (3)
где  - алгебраическая сумма энтропии конечных веществ с учетом стехиометрических коэффициентов у этих веществ, Дж/(моль*К);
- алгебраическая сумма энтропии конечных веществ с учетом стехиометрических коэффициентов у этих веществ, Дж/(моль*К);
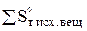 - алгебраическая сумма энтропии исходных веществ реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/(моль*К).
- алгебраическая сумма энтропии исходных веществ реакции с учетом стехиометрических коэффициентов у этих веществ, Дж/(моль*К).
Для (1) изменение энтропии реакции при 1000 К равна:


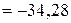 Дж/(моль*К).
Дж/(моль*К).
 Дж/(моль*К).
Дж/(моль*К).
4. ОПРЕДЕЛЕНИЕ ИЗМЕНЕНИЯ ЭНЕРГИЙ ГИББСА РЕАКЦИИ ПРИ ЗАДАННОЙ ТЕМПЕРАТУРЕ
Изменение энергии Гиббса реакции при заданной температуре Т определяют по следующему уравнению:
 , (4)
, (4)
где  - изменение энтальпии реакции при заданной температуре Т, Дж/моль;
- изменение энтальпии реакции при заданной температуре Т, Дж/моль;
 - изменение энтропии реакции при заданной температуре Т, Дж/(моль.К).
- изменение энтропии реакции при заданной температуре Т, Дж/(моль.К).
Для (1) изменение энергии Гиббса реакции при 1000 К равна:

 Дж/(моль.К).
Дж/(моль.К).
Отрицательное значение изменения энергии Гиббса показывает, что реакция идет слева направо, т.е. в сторону образования конечных продуктов MgOтв и Н2r.
5. ОПРЕДЕЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ РЕАКЦИИ ПРИ ЗАДАННОЙ ТЕМПЕРАТУРЕ
Константа равновесия любой реакции или любого процесса определяется из следующего выражения:
 ,
,
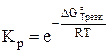 , (5)
, (5)
где Кр – константы равновесия реакции при постоянном давлении р и заданной температуре Т оС при Кр>1 реакция идет слева направо; при Кр<1 реакция идет справа налево; при К=1 в реакции устанавливается динамическое равновесие);
 - изменение энергии Гиббса реакции при заданной температуре Т, Дж/моль; R – универсальная газовая постоянная, (Дж/моль*К), R=8,314 Дж/(моль*К); Т – абсолютная температура реакции, К; е – основание натуральных логарифмов, е=2,718.
- изменение энергии Гиббса реакции при заданной температуре Т, Дж/моль; R – универсальная газовая постоянная, (Дж/моль*К), R=8,314 Дж/(моль*К); Т – абсолютная температура реакции, К; е – основание натуральных логарифмов, е=2,718.
Для (1) константа равновесия Кр равна:
 .
.
Вычисленное значение  показывает, что реакция
показывает, что реакция  при 1000 К идет слева направо, т.е. в сторону образования MgOтв и Н2г.
при 1000 К идет слева направо, т.е. в сторону образования MgOтв и Н2г.
6. ОПРЕДЕЛЕНИЕ ПОЛНОТЫ ПРОТЕКАНИЯ РЕАКЦИИ ПРИ ЗАДАННОЙ ТЕМПЕРАТУРЕ
Полнота протекания реакции вида Аж+Вг=Дтв+Ег (выход продуктов реакции) при заданной температуре Т в изобарных условиях определяется по следующему уравнению
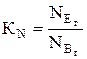 , (6)
, (6)
где  - мольная доля конечного вещества Е в газообразном состоянии;
- мольная доля конечного вещества Е в газообразном состоянии;
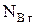 - мольная доля исходного вещества В в газообразном состоянии) после подставки в него вместо КN вычисленного значения Кр, т.е.
- мольная доля исходного вещества В в газообразном состоянии) после подставки в него вместо КN вычисленного значения Кр, т.е.  . Мольные доли газовых фаз в уравнение (6) подставляются из предварительно заполненной таблицы для заданной реакции.
. Мольные доли газовых фаз в уравнение (6) подставляются из предварительно заполненной таблицы для заданной реакции.
Применительно к (1) это табл.2.
Таблица 2.
| Вещества (компоненты), моли | 
| 
| 
| 
|
| Было до реакции | - | - | ||
| Ушло в реакцию | х | х | - | - |
| В реакции при 1000 К | 1-х | 1-х | х | х |
| Общее число молей газа в реакции при 1000 К | ||||
| Мольные доли газов в реакции при 1000 К | 1-х | х |
 ;
;
 ;
;
 ;
;
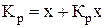 ;
;
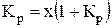 ;
;
 .
.
Таким образом, выход продуктов реакции  при 1000 К следующий:
при 1000 К следующий:
 ;
;  , т.е. реакция прошла практически полностью (
, т.е. реакция прошла практически полностью ( ;
;  ).
).
7. ЗАКЛЮЧЕНИЕ
В заключение на основании выполненных расчетов  ,
, 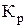 и мольных долей веществ заданной реакции при определенной температуре Т необходимо сделать выводы о направлении и полноте протекания этой реакции.
и мольных долей веществ заданной реакции при определенной температуре Т необходимо сделать выводы о направлении и полноте протекания этой реакции.
Применительно к реакции Mg+Н2О=MgO+H2 при 1000 К эти выводы следующие: так как  Дж/моль и
Дж/моль и  , то реакция идет слева направо, в сторону образования конечных продуктов. Рассчитанный выход продуктов реакции Н2=х=1 и MgOтв=х=1 свидетельствует о том, что эта реакция прошла практически полностью.
, то реакция идет слева направо, в сторону образования конечных продуктов. Рассчитанный выход продуктов реакции Н2=х=1 и MgOтв=х=1 свидетельствует о том, что эта реакция прошла практически полностью.
8. СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Теплотехника: учебник для вузов /М.Г. Шатров [и др.]; под ред. М.Г. Шатрова.— 3-е изд., стер. — Москва: Академия, 2013. — 288 с.: ил. — ISBN 978-5-7695-9543-1.
2. Буданов, В.В. Химическая термодинамика: учеб. пособие для вузов /В.В. Буданов, А.И. Максимов; под ред. О.И. Койфмана. — М.: Академкнига, 2007. — 312 с.: ил. — ISBN 978-5-94628-300-7.
3. Козырев А.В. Термодинамика и молекулярная физика [Электронный ресурс]: учебное пособие /Козырев А.В. — Электрон. текстовые данные. — Томск: Эль Контент, Томский государственный университет систем управления и радиоэлектроники, 2012. — 114 c. — Режим доступа: http://www.iprbookshop.ru/13871. — ЭБС «IPRbooks», по паролю.
4. Исаев, С.И. Термодинамика: Учебник для техн. ун-тов и вузов /С.И. Исаев. — 3-е изд., перераб. и доп. — М.: Изд-во МГТУ им. Н.Э. Баумана, 2000. — 416 с.: ил. — ISBN 5-70-1724-2.
5. Гончаров, С.А. Термодинамика: Учебник для вузов /С.А. Гончаров. — 2-е изд., стер. — М.: МГГУ, 2002. — 440 с.: ил. — ISBN 5-7418-0010-6.
6. Глаголев, К.В. Физическая термодинамика: Учеб. пособие для вузов /К.В. Глаголев, А.Н. Морозов. — М.: Изд-во МГТУ им. Н.Э. Баумана, 2004. — 272 с.: ил. — ISBN 5-7038-2208-4.
7. Карякин, Н.В. Основы химической термодинамики: Учеб. пособие для вузов /Н.В. Карякин. — М.: Академия, 2003. — 464 с.: ил. — ISBN 5-7695-1596-1.
8. Василевский, А.С. Термодинамика и статистическая физика: Учеб. пособие для вузов /А.С. Василевский. — 2-е изд., перераб. — М.: Дрофа, 2006. — 240 с.: ил. — ISBN 5-7107-9408-2.
ВАРИАНТЫ ЗАДАНИЙ ПО ККР
Определение направления и полноты протекания физико-химической реакции……………….. при температуре…………………….
| № вари-анта | Физико-химическая реакция | Температура реакции, К |

| ||

| ||

| ||
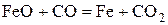
| ||
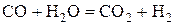
| ||
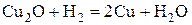
| ||

| ||

| ||

| ||
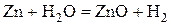
| ||

| ||

|
| <== предыдущая | | | следующая ==> |
| | | Рассылка сообщения |
Date: 2015-06-11; view: 280; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |