
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Величина доннановой разности потенциалов
|
|
Закономерности, которым подчиняется доннаново равновесие между фазами и, в частности, доннанов потенциал, основываются на общих термодинамических представлениях, развитых Гиббсом. Первоначально Доннан рассмотрел условие равновесия без учета коэффициентов активности. Позже Гюккель, а затем Доннан и Гуггенгейм дали точный термодинамический анализ задачи с учетом коэффициентов активности всех ионов и растворителя.
а) 1,1-Валентные электролиты
Обозначим по-прежнему переходящие анионы и катионы буквами А и К, а закрепленные ионы фазы 1 — через R.Ион R может иметь и положительный, и отрицательный заряд zR.Будем считать, что оба электролита уже находятся друг с другом в равновесии как по катионам, так и по анионам. Это значит, что электрохимический потенциал любого данного иона имеет в обеих фазах одну и ту же величину Можно, следовательно, записать:
 ,
, 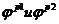 - внутренние потенциалы фаз 1 и 2.
- внутренние потенциалы фаз 1 и 2.
Складывая уравнения, находим:
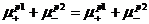
Т.к. стандартный химический потенциал каждого сорта ионов в обеих фазах одинаков, то из уравнения вытекает следующее условие доннанового равновесия:
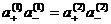
В состоянии равновесия на границе раствор электролита/ ионообменная мембрана формируется двойной электрический слой (ДЭС). Скачок потенциала между двумя произвольными точками за пределами внешних границ ДЭС называется доннановским потенциалом 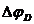 . Если концентрации (моль/л) ионов в растворе
. Если концентрации (моль/л) ионов в растворе 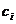 и в мембране
и в мембране 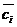 , потенциал Доннана будет определяться выражением:
, потенциал Доннана будет определяться выражением:
 ,
,
где 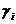 ,
, 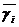 коэффициенты активности i-го иона в фазе раствора и в фазе мембраны. Как правило, слагаемое
коэффициенты активности i-го иона в фазе раствора и в фазе мембраны. Как правило, слагаемое 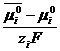 опускают, принимая, что его косвенно учитывают коэффициенты активности, либо вносят под знак логарифма в виде коэффициента распределения ki i-го иона между фазами раствора и ионообменника. Предполагается, что коэффициенты активности косвенно учитывают осмотическое давление (осмотическая теория сорбции).
опускают, принимая, что его косвенно учитывают коэффициенты активности, либо вносят под знак логарифма в виде коэффициента распределения ki i-го иона между фазами раствора и ионообменника. Предполагается, что коэффициенты активности косвенно учитывают осмотическое давление (осмотическая теория сорбции).
Возникновение доннановского потенциала препятствует выравниванию концентраций противо- и коионов в фазе раствора и в фазе мембраны.
Чтобы найти в доннановой системе равновесные концентрации, нужно учесть еще условие электронейтральности, которое для данного случая сводится к равенствам:
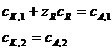 ,
,
где 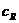 - молярная концентрация ионообменных групп, являющаяся важной характеристикой.
- молярная концентрация ионообменных групп, являющаяся важной характеристикой.
Если учитывать средний коэффициент активности 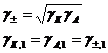
После некоторых преобразований получим:
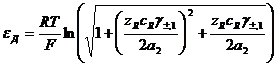
Доннанов потенциал ионита по отношению к внешней фазе положителен, когда ионообменные группы положительны, и отрицателен, когда они отрицательны. Если концентрация ионообменных групп очень велика по сравнению с концентрацией окружающего электролита, так что 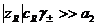 , то уравнение упрощается:
, то уравнение упрощается:
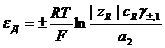
Знак плюс перед дробью соответствует положительным значениям zR знак минус — отрицательным. Ионы того же знака, что и ионообменные группы, имеют в этом случае в фазе 1 настолько низкую концентрацию, что ею вообще можно пренебречь, Но тогда, по условиям электронейтральности, концентрация подвижных противоионов в фазе 1 должна быть практически равна концентрации ионообменных групп, т. е. она должна почти не зависеть от концентрации этого противоиона в фазе 2 (практически это означает полное насыщение ионита данным ионом).
Диффузионные (неравновесные потенциалы), или жидкостные потенциалы, а точнее, разность потенциалов, возникают в пограничной зоне между двумя разными соприкасающимися электролитами. Причина их появления кроется в различи подвижностей, или коэффициентов диффузии растворенных ионов. Градиенты концентраций, точнее градиенты активностей, существующие в пограничной зоне, порождают диффузию. При независимой диффузии заряды положительных и отрицательных ионов, переходящих границу, друг друга не компенсируют. Это значит, что при такой независимой диффузии через границу электролитов должен течь соответствующий электрический ток. Если внешнего тока в цепи нет, то на границе растворов в результате этого перемещения зарядов неизбежно возникает электрическое поле, которое затрудняет переход для одних ионов и облегчает его для других. Разность потенциалов принимает установившееся значение, когда скорости перехода положительных и отрицательных зарядов через границу в точности уравниваются. Тогда результирующий ток на границе становится равным нулю. Эта стационарная разность потенциалов и есть диффузионный потенциал.
Подавление (элиминирование) диффузионного потенциала
Во многих электрохимических исследованиях используются цепи, составленные из электродов с разными электролитами. При этом возможно появление диффузионных потенциалов, которые трудно измерить или рассчитать. Существует, однако, метод, позволяющий иногда настолько снизить величину диффузионного потенциала, что им уже практически можно пренебречь. Заключается метод в том, что электролиты обоих электродов соединяются через концентрированный (обычно насыщенный) раствор хлорида калия, называемый «солевым мостиком». С той же целью можно попользовать растворы нитратов калия или аммония. Рассмотрим цепь
Hg | Hg2Cl2, НС1(с) || КСl(4,2 М) || КС1(0,1 М), Hg2Cl2 |Hg
Без мостика диффузионный потенциал в такой цепи при с = 0,1 М составляет 28,2 мв; с мостиком из 3,5 М раствора KCl он снижается до 1,1 мв. Причину этого легко понять, обратившись к уравнению Гендерсона:
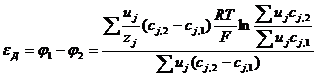 [Феттер]
[Феттер]
Разности потенциалов, возникающие на пористых полупроницаемых мембранах, являются классическими доннановыми потенциалами, которые уже рассматривались. Иначе ведут себя ионитовые мембраны. В известном смысле слова они тоже могут считаться полупроницаемыми, хотя фактором, определяющим проницаемость, здесь оказывается не столько величина иона, сколько его заряд (справедливо только в том случае, когда емкость ионита уже исчерпана, и он почти полностью насыщен упомянутым многозарядным ионом. В практике обычного ионного обмена это бывает довольно редко, но с этим приходится сталкиваться при применении ионитовых мембран). Мембраны, этого типа и возникающие на них потенциалы играют чрезвычайно большую роль в физиологических процессах. В их исследовании важное место занимают фундаментальные работы Теорелла, Майера и Си-верса, Манеке, Бонхёффера с сотрудниками, Шлёгеля, Хельфериха, Шмида.
Мембранным называют потенциал, возникающий между двумя растворами различного состава, разделенными мембраной. В общем виде системы, в которых наблюдается мембранный потенциал, имеют следующую структуру:
Электрод сравнения 1| раствор 1| мембрана | раствор 2 | электрод сравнения 2
В этой системе для измерения разности потенциалов, возникающей на мембране, необходимо использовать два электрода сравнения. Разность потенциалов зависит от природы мембраны и от концентрации ионов, входящих в растворы 1 и 2. К классу мембранных электродов относятся и стеклянные, и ион-селективные электроды. Мембраны электродов могут быть твердыми и жидкостными, они могут разделять идентичные или неидентичные растворы. [Плембек] Мембраны можно рассматривать как трехкомпонентные системы: межфазная область на границе раствора 1 с мембраной, однородная область основной части мембраны и межфазная область на границе мембраны с раствором 2. Полный мембранный потенциал слагается из трех разновидностей потенциалов (диффузионного потенциала внутри мембраны и двух скачков потенциала на границе фаз, называемых доннановскими потенциалами, если в пленках растворов, прилегающих к мембране, существуют концентрационные градиенты, то добавляются еще диффузионные потенциалы в этих пленках).
Каждая сторона мембраны приходит в равновесие со смачивающим ее раствором. При этом возникают две доннановых разности потенциалов 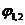 и
и 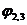 . Если концентрации
. Если концентрации 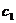 и
и 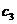 неодинаковы, то, по условиям равновесия, должны быть различны и концентрации в поверхностных слоях мембраны, непосредственно прилегающих к этим растворам. Следовательно, внутри мембраны должен существовать некоторый градиент концентрации, а значит и какая-то (обычно очень незначительная) диффузия и соответствующий диффузионный потенциал.
неодинаковы, то, по условиям равновесия, должны быть различны и концентрации в поверхностных слоях мембраны, непосредственно прилегающих к этим растворам. Следовательно, внутри мембраны должен существовать некоторый градиент концентрации, а значит и какая-то (обычно очень незначительная) диффузия и соответствующий диффузионный потенциал.
В общем случае 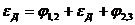
Для 1,1-валентного электролита величина мембранного потенциала:
 , где
, где 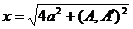 ;
;
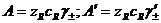
при 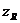 >0 целесообразно применять для анионов;
>0 целесообразно применять для анионов;
при 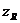 <0 применяют для катионов;
<0 применяют для катионов;
среднее значение активности 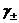 - на границе фаз 1,2;
- на границе фаз 1,2;
а 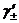 - на границе 2,3.
- на границе 2,3.
Во внешнем растворе 1,1- валентного электролита концентрация анионов всегда равна концентрации катионов. В мембране эти концентрации отличаются друг от друга, поскольку должно выполняться условие электронейтральности, которое при выбранной валентности электролита имеет вид:
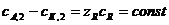
Когда 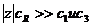 , суммарный заряд подвижных противоионов в мембране, по условиям электронейтральности доннанова равновесия, оказывается почти равен суммарному заряду ионообменных групп
, суммарный заряд подвижных противоионов в мембране, по условиям электронейтральности доннанова равновесия, оказывается почти равен суммарному заряду ионообменных групп 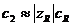 . Тогда концентрация в мембране сопутствующего иона, т.е. второго подвижного иона, имеющего знак, одинаковый с ионообменными группами, приближенно выражается уравнением:
. Тогда концентрация в мембране сопутствующего иона, т.е. второго подвижного иона, имеющего знак, одинаковый с ионообменными группами, приближенно выражается уравнением:  , где с-концентрация во внешнем растворе. Величина
, где с-концентрация во внешнем растворе. Величина 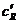 очень мала, значит и перепад ее внутри тем более мал. Значит перепад концентрации основных противоионов внутри ионита так же мал. Поэтому диффузионный потенциал в таких системах очень невелик и им можно пренебречь. Второй член в скобках также стремится к нулю. (вблизи мембраны значения активностей и чисел переноса не меняются) В результате уравнение мембранного потенциала сильно упрощается:
очень мала, значит и перепад ее внутри тем более мал. Значит перепад концентрации основных противоионов внутри ионита так же мал. Поэтому диффузионный потенциал в таких системах очень невелик и им можно пренебречь. Второй член в скобках также стремится к нулю. (вблизи мембраны значения активностей и чисел переноса не меняются) В результате уравнение мембранного потенциала сильно упрощается:
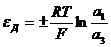 , знак плюс отвечает аниониту, знак минус – катиониту.
, знак плюс отвечает аниониту, знак минус – катиониту.
В другом крайнем случае, когда 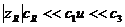 , уравнение переходит в следующее выражение:
, уравнение переходит в следующее выражение:
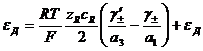 .
.
По мере увеличения внешней концентрации первый член в правой части этого уравнения все более приближается к нулю и, в конце концов, мембранный потенциал переходит в диффузионный потенциал. В общем случае величина мембранного потенциала заключена между напряжением концентрационной цепи и диффузионным потенциалом.
Мембранные потенциалы чувствительны к природе мембраны, а также к применяемым по обе стороны от нее электродам сравнения и к концентрации ионов в исследуемым растворе. Обычно электрод сравнения, стандартный раствор и сама мембрана во всей серии определений остаются одними и теми же, меняется только активность ионов в исследуемом растворе.
Date: 2015-07-17; view: 864; Нарушение авторских прав