
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

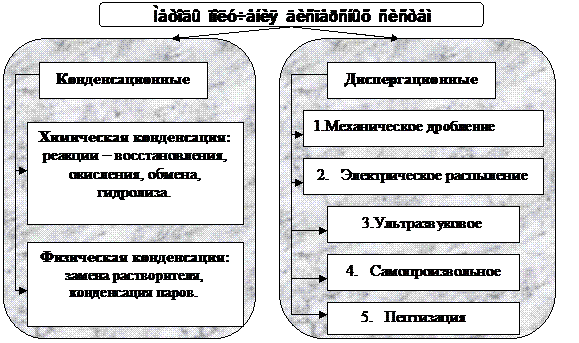
Краткое теоретическое обоснование. Все методы получения дисперсных систем сводятся либо к объединению (укрупнению) или ионов в агрегаты дисперсной фазы (методы конденсации)
|
|
Все методы получения дисперсных систем сводятся либо к объединению (укрупнению) или ионов в агрегаты дисперсной фазы (методы конденсации), либо к доведению крупных частиц вещества до определенной степени дисперсности (раздробленности) – методы диспергирования.
Диспергированием называют тонкое измельчение твердых материалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате чего образуются дисперсные системы: порошки, суспензии, эмульсии, аэрозоли.
В случае химической конденсации новая фаза возникает при протекании реакций, приводящих к образованию нерастворимых в данной среде веществ. При получении золей методами химической конденсации следует отдавать предпочтение реакциям, при которых попутно с труднорастворимым соединением образуются вещества, являющиеся неэлектролитами или слабыми электролитами. Это способствует получению более стабильных золей, так как в системе не образуются излишние электролиты, астабилизируюшие золь.
При физической конденсации дисперсная фаза получается без протекания химической реакции, но при возникновении условий, когда вещество переходит в пересыщенное состояние.
Цель работы. Научиться получить коллоидные растворы различными методами и написать коллоидно-химические формулы мицелл полученных золей, исследовать некоторые свойства золей и растворов ВМС.
Оборудование: пробирки, пипетки, стаканчики, цилиндры, спиртовки, спички и бумажный фильтр.
Реактивы: 5%-ный раствор канифоли в этаноле, 0,25% и 6%- ные растворы желатина, 0,01 М раствор перманганата калия, 0,1 М и 0,2 М растворы щавелевой кислоты, раствор гидроксида аммония, 2%-ный раствор хлорида железо (III), насыщенные растворы гексацианоферрата (II) и сульфата калия, 1 М растворы сульфата, ацетата, хлорида, нитрата, родонида калия.
Опыт №1. Получение золя канифоли замены растворителя
Принцип метода. Метод основан на применении физической конденсации.
Ход работы:
1. К 5 мл дистиллированной воды добавьте при взбалтывании  7 капель 5%-го раствора канифоля в этиловом спирте. Образуется молочно-белый опалесцирующий золь канифоля в воде с отрицательным зарядом частиц. Примечание! Если золь необходимо сохранить длительное время, то спирт можно удалить диализом.
7 капель 5%-го раствора канифоля в этиловом спирте. Образуется молочно-белый опалесцирующий золь канифоля в воде с отрицательным зарядом частиц. Примечание! Если золь необходимо сохранить длительное время, то спирт можно удалить диализом.
2. Выводы. Объясните, почему в спирте канифоль образует истинный раствор, а в воде – коллоидный? О чем свидетельствует эффект Тиндаля?
Опыт №2. Получение золя марганец диоксида / 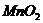 / методом окисления - восстановления
/ методом окисления - восстановления
Принцип метода. Метод основан на применении химической конденсации.
Ход работы:
1. К 5—10 мл раствора калий перманганата /  / с молярной концентрацией эквивалента 0,01 моль/л добавьте 2—5 мл разбавленного (1:6) раствора аммоний гидроксида, а затем 5—10 мл раствора щавелевой кислоты /
/ с молярной концентрацией эквивалента 0,01 моль/л добавьте 2—5 мл разбавленного (1:6) раствора аммоний гидроксида, а затем 5—10 мл раствора щавелевой кислоты / 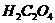 / с молярной концентрацией эквивалента 0,1 моль/л и нагрейте до кипения. Получается золь марганец диоксида бурого цвета:
/ с молярной концентрацией эквивалента 0,1 моль/л и нагрейте до кипения. Получается золь марганец диоксида бурого цвета:
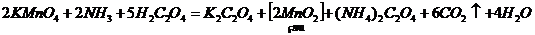 .
.
2. Выводы. Напишите строение мицеллы золя, определите, к какому электроду (к катоду или к аноду) будет двигаться коллоидная частица:
Опыт №3. Получение золя железо (III) гидроксида 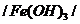 методом гидролиза
методом гидролиза
Принцип метода. Метод основан на применении химической конденсации. Реакция гидролиза есть частичный случай реакции двойного обмена.
Ход работы:
1. В пробирке доведите до кипения 5 мл дистиллированной воды (для повышения степени гидролиза), добавьте 1 мл 2%-ного раствора железо (III) хлорида. Как только произойдет изменение окраски до кирпично-красного цвета, прекратите нагревание. Получается золь железо (III) гидроксида. Реакция получения 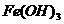 идет по схеме:
идет по схеме:
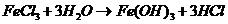
Поверхностные молекулы агрегата 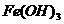 вступают в реакцию с
вступают в реакцию с 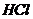 т.е. происходит частичное растворение
т.е. происходит частичное растворение 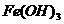 :
:
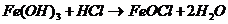 .
.
Образующийся оксохлорид железа / 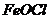 /, подвергаясь диссоциации, образует ионы:
/, подвергаясь диссоциации, образует ионы: 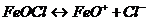 . Данное обстоятельство необходимо учесть при составлении формулы мицеллы. Гидрозоль оставить для выполнения опыта №5.
. Данное обстоятельство необходимо учесть при составлении формулы мицеллы. Гидрозоль оставить для выполнения опыта №5.
2. Выводы. Сравните цвет золя с цветом исходного раствора хлорида железа. Напишите химическую формулу мицеллы золя гидроксида железо (III), учитывая, что потенциалопределяющие ионы дает хлорокись железа.
Опыт №4. Получение золя берлинской лазури методом пептизации на фильтре
Date: 2015-07-17; view: 1200; Нарушение авторских прав