
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Лабораторная работа № 4. Ионообменная очистка сточных вод от ионов хрома (VI)
|
|
Ионообменная очистка сточных вод от ионов хрома (VI)
Хромовая кислота и её соли широко используются в гальванических производствах для нанесения на поверхность металла хромовых покрытий, в кожевенной промышленности и др. При этом образуются высокотоксичные сточные воды, содержащие ионы Cr2O72- или CrO42-. Для очистки таких вод широко используются ионообменные методы.
Цель работы: определить динамическую ионообменную ёмкость анионита АВ-17 по отношению к ионам Cr2O72-.
Приборы и оборудование:
1. Ионообменная колонка;
2. Конические колбы;
3. Мерные пипетки;
4. Бюретки.
Реактивы:
1. Ионообменная смола АВ-17 в ОН— форме;
2. Соль Мора 0,05н раствор;
3. Серная кислота, разбавленная 1:1;
4. Индикатор – раствор ферроина.
Порядок выполнения работы
Опыт 1. Определение ионов Cr2O72- в модельном растворе
Концентрацию бихромат-ионов в растворе определяют методом объемного титрования, основанном на протекании следующей окислительно-восстановительной реакции:
Cr2O72- + 6Fe2++ 14H+ = 2Cr3+ + 6Fe3+ +7H2O
Для титрования в мерную колбу отбирают пипеткой 10 мл исследуемой воды, добавляют 5 мл раствора серной кислоты и 5 капель индикатора – ферроина. Титруют 0,05н раствором соли Мора до перехода окраски из красно-фиолетовой в зеленую. Концентрацию ионов Cr2O72- (моль-экв/л) определяют по закону эквивалентов:
Сн0 = 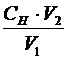 , (5)
, (5)
где Сн – нормальность раствора соли Мора (моль-экв/л);
V1- объем анализируемого раствора (мл);
V2- объем соли Мора, пошедший на титрование (мл).
Среднее значение концентрации Cr2O72- вычисляют из трёх параллельных определений.
Опыт 2. Извлечение ионов Cr2O72- ионов методом ионного обмена
Ионообменную колонку заполняют 3 мл набухшего анионита АВ-17 в ОН— форме и пропускают через неё 300-500 мл модельной сточной воды, фильтрат отбирают порциями по100 мл. В каждой отобранной пробе определяют концентрацию Cr2O72 .Емкость анионита (Е, мг-экв) рассчитывают по формуле:
Е = (С0 – Сn)·· V·1000 (6)
где: С0- исходная концентрация Cr2O72- (г-экв/л);
Сn - концентрация ионов Cr2O72- в анализируемой пробе (г-экв/л);
V – объем пробы (л);
1000 – коэффициент пересчета г-экв в мг-экв.
Результаты экспериментов заносят в таблицу. По полученным данным строят выходную кривую ионного обмена и определяют ионообменную ёмкость анионита до проскока 0,1 мг хрома (VI) в пересчете на концентрацию ионов Cr2O72- в фильтрате.
Таблица
| №№ | Объём порции, (л) | Суммарный объём, (л) | Концентра-ция Cr2O72- в пробе (мг- экв/л) | Емкость катионита, (мг- экв) | Суммарная емкость катионита, (мг-экв) |
| 0,100 | 0,100 | ||||
| 0,100 | 0,200 | ||||
| 0,100 | 0,300 |
Date: 2015-07-17; view: 916; Нарушение авторских прав