
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Влияние концентрации фермента на скорость ферментативной реакции
|
|
Концентрация фермента оказывает существенное влияние на скорость ферментативной реакции. При насыщающей концентрации субстрата, обеспечивающей Vmax, начальная скорость ферментативной реакции будет, в первую очередь, зависеть от концентрации фермента. Эта зависимость прямо пропорциональная, что свидетельствует о том, что начальная скорость является мерой количества фермента.
Влияние температуры на активность ферментов. Общий вид кривой, характеризующей влияние температуры на активность фермента, можно представить в виде графика, изображенного на рис. 1.
Температурный оптимум большинства растительных ферментов 313—333 К, животных ферментов 313—323 К. Если температура превысит эти пределы, активность фермента очень быстро падает, а при 343—353 К происходит их необратимое разрушение, обусловленное денатурацией белка . Лишь очень немногие ферменты способны в определенных условиях выдержать нагревание до 373 К без потери активности.
Наибольшую активность оии проявляют при 25—35° С. Большинство ферментов разрушается при 55—60° С.
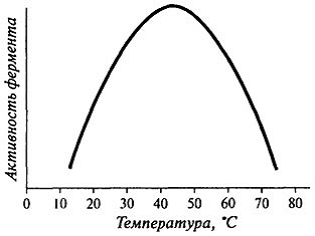 Рис. 1 Влияние температуры на активность фермента
Рис. 1 Влияние температуры на активность фермента
При повышении температуры выше обычной температуры действия фермента его активность временно возрастает, но затем снижается. По достижении температуры, при которой активность фермента становится равной нулю, белок денатурируется.
Влияние температуры на активность фермента, которое может быть легко изучено экспериментально, имеет очень сложный характер, так как обусловлено целым рядом факторов, а именно:
- влиянием температуры на скорость расщепления комплекса ES на свободный фермент и продукт реакции, т. е. на константу скорости реакции
- влиянием температуры на сродство фермента к субстрату, то есть на константы k+1 и k_,;
- влиянием на теплоту ионизации, а, следовательно, на процессы ионизации всех компонентов реакции: самого фермента, субстрата, промежуточных и конечных продуктов реакции;
- влиянием на образование таких соединений, как "фермент-активатор" или "фермент-ингибитор";
- влиянием на процесс денатурации ферментного белка.
Экспериментальные исследования показали, что любой конкретный фермент проявляет максимальную активность при температурах, близких к нормальной температуре организма, в котором находится данный фермент. Вторичная и третичная структуры белковой молекулы фермента, от которых зависит активность активного центра, поддерживаются множеством слабых сил, удерживаюших белковую цепь в определенной конфигурации. Нагревание приводит к разрушению прежней структуры белковой цепи фермент денатурируется и полностью теряет свою активность.
Влияние рН на активность ферментов. Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность.
Активность различных ферментов, а также специфика происходящих в тканях биохимических процессов тесно связаны с определенными довольно узкими интервалами pH. Например, пепсин желудочного сока активен при pH = 1,5—2,0 содержащийся в слюне птиалин, ускоряющий процесс осахаривания крахмала, наиболее активен при pH = 6,7, т. е. почти в нейтральной среде. В зависимости от pH среды ферменты могут катализировать совершенно различные реакции. Так, тканевые катепсииы при реакции среды, близкой к нейтральной, катализируют синтез белка, а прикислой реакции его расщепление. При отклонении величины pH от оптимальных значений активность ферментов, как показывает опыт, сильно снижается нли даже вовсе прекращается, что в конечном итоге приводит организм к гибели.
Влияние активаторов и ингибиторов. Активаторами называют вещества, которые повышают активность ферментов. Хорошим примером таких соединений являются аминокислота цистеин и восстановленный глутатион, содержащие свободную SH-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием SH-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций.
Ингибиторами называют вещества, специфически снижающие активность ферментов. Снижение или полная потеря активности ферментов могут быть вызваны разного рода денатурирующими воздействиями, в этом случае правильнее употреблять термин "инактивация" фермента.
| <== предыдущая | | | следующая ==> |
| Работа со СМИ | | |
Date: 2015-07-17; view: 1131; Нарушение авторских прав