
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Третья стадия — электронно-транспортная цепь (ЭТЦ)
|
|
В процессе окисления пировиноградной кислоты в цикле Кребса образовались пары водорода 2Н, которые мы можем рассматривать как 2Н+ + 2е-. Именно в таком виде они, акцептированные НАД и ФАД, и передаются по цепи переносчиков. В процессе переноса водорода и электронов важную роль играют ферменты, относящиеся к классу оксидоредуктаз.
Оксидоредуктазы, участвующие в дыхательной цепи, делятся на следующие основные группы:
1)Пиридиновые дегидрогеназы, у которых коферментом служит НАД или НАДФ, отнимают два атома водорода от субстрата. При этом к коферментам присоединяются один протон и два электрона. Протон и один электрон связываются с атомом углерода в молекуле НАД, а второй электрон нейтрализует положительный заряд атома азота. Один протон выделяется в среду. Коферменты НАД и НАДФ связаны с ферментом с помощью ионов металла и сульфгидрильных группировок. В зависимости от белкового носителя, к которому присоединен кофермент (НАД или НАДФ), различают более 150 пиридиновыхдегидрогеназ. Каждая из них специфична по отношению к определенному субстрату. Необходимо учитывать, что НАД и НАДФ могут воспринимать водород и электроны лишь в том случае, если субстрат имеет более отрицательное значение потенциала по сравнению с ними.
2) Флавиновыедегидрогеназы. Это также большая группа ферментов, катализирующая отнятие 2Н от различных субстратов. Простетической группой этих ферментов служат производные витамины В2 (рибофлавина) — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновыхдегидрогеназ служит изоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н+ +2е). Простетическая группа у флавиновыхдегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
3) Цитохромы. Простетическая группа цитохромов представлена железопорфиринами. Железопорфириновая группа (тем) в цитохромах прочно связана с белком через атомы серы аминокислоты цистеина. Известно около 20 цитохромов, которые делятся на четыре главных класса: а, b, с, d, отличающихся между собой природой простетической группы: цитохромы а содержат железоформилпорфирины, цитохромы b — железопротопорфирины, цитохромы d — железогидропорфирины. В каждую группу цитохромов входит по нескольку различающихся между собой ферментов.
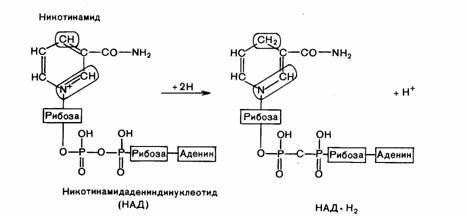
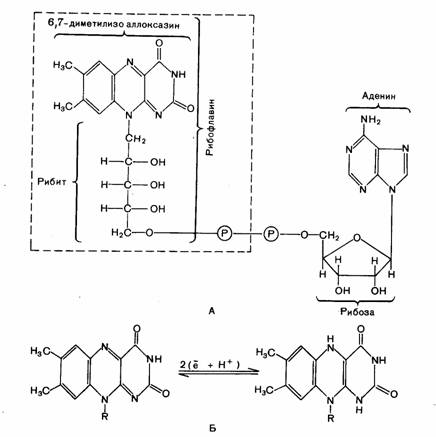
Роль цитохромов заключается в переносе электронов. Содержащееся в цитохромах железо способно к обратимым окислительно-восстановительным реакциям. Воспринимая электрон, железо восстанавливается, теряя его — окисляется: Fe3+ +е-→ Fe2+. Непосредственно с кислородом воздуха может реагировать только цитохромоксидаза, которая кроме железа содержит атомы меди.
Помимо перечисленных ферментов в переносе электронов по дыхательной цепи принимают участие кофермент Q и железосерные белки. Кофермент Q – это производное бензохинона, получившее название убихинон. Убихинон представляет собой кольцевую молекулу с двумя присоединенными к ней атомами кислорода, для которой возможны три состояния. В полностью окисленном состоянии, или хиноновой форме, оба атома кислорода связаны с кольцом двойными связями. Присоединение одного атома водорода к одному из атомов кислорода дает полухиноновую форму QH. В полностью восстановленной форме атомы водорода присоединяются к обоим атомам кислорода. Эта форма носит название гидрохиноновой — QH2.
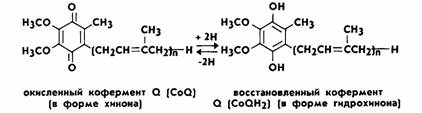
Таким образом, кофермент Q может присоединять 2 протона и 2 электрона. Убихинон растворим в жирах и в связи с этим подвижен в липидной фазе мембран. Железосерные белки содержат FeS — это переносчики электронов подобно цитохромам. Содержащееся в них железо обратимо восстанавливается и окисляется.
Путь переноса водорода и электрона от одной молекулы переносчика к другой представляет собой окислительно-восстановительный процесс. При этом молекула, отдающая электрон или водород, окисляется, а молекула, воспринимающая электрон или водород, восстанавливается. Движущей силой транспорта водорода в дыхательной цепи является разность потенциалов. В связи с этим расположение отдельных переносчиков в дыхательной цепи, так же как и в цепи фотосинтетической, определяется величиной их окислительно-восстановительного потенциала (О/В). В начале цепи расположен НАД, обладающий наибольшей отрицательной величиной О/В потенциала (—0,32 В), а в конце — кислород с наиболее положительной величиной (+0,82 В). Остальные переносчики ФАД, KoQ,цитохромы расположены между ними в порядке последовательного повышения положительного потенциала. Это и позволяет электронам передвигаться по направлению к кислороду (наивысший положительный потенциал).
В 1939—1940 гг. биохимик В. А. Белицер указал, что выделяющаяся в процессе передачи по дыхательной цепи электронов энергия частично накапливается в АТФ. При переносе электронов свободная энергия системы постепенно уменьшается. Общее изменение энергии при переносе пары водородов и пары электронов от НАД на кислород можно рассчитывать по формуле: ∆Go = nF∆Eo, где n — число электронов, равное 2; F — фарада = 96 633,97 Дж; ∆ Eo — разность потенциалов между участком цепи от —0,32 до +0,82= 1,14; ∆ Go — стандартное изменение свободной энергии, ∆ Gо = 2-96633,97 Дж-1,14 = 220,8 кДж.
Таким образом, изменение свободной энергии системы составляет около 220,8 кДж. Свободная энергия гидролиза АТФ равна 30,6 кДж. Исходя из того, что уменьшение свободной энергии системы при переносе пары электронов сНАД на кислород составляет 220,8 кДж, можно было предположить возможность образования из АДФ + Фн семи молекул АТФ. Однако было показано, что при прохождении пары электронов от НАД·Н2 до 1/2 О2 образуется всего 3 молекулы АТФ. Из этого был сделан вывод, что в цепи переноса электронов имеется три пункта фосфорилирования. Накопление энергии окисления в АТФ при продвижении электрона по цепи переносчиков называют окислительным фосфорилированием. Механизм образования АТФ в процессе окислительного фосфорилирования, так же как и фотофосфорилирования, объяснен благодаря работам английского биохимика П. Митчелла. Его теория получила название хемиосмотической. Согласно хемиосмотической теории свободная энергия, образованная при окислительно-восстановительных реакциях в дыхательной цепи, преобразуется в электрохимический градиент ионов водорода (∆μН +). При этом мембрана переходит в высокоэнергетическое состояние. Ионы Н+ (протоны) переносятся с внутренней стороны внутренней мембраны на ее внешнюю сторону, иначе говоря, из матрикса митохондрии в межмембранное пространство с помощью переносчиков. ∆μН +, в свою очередь, является источником энергии для образования АТФ из АДФ. ∆μН+ имеет две составляющие: градиент рН (∆ рН) и градиент электрического потенциала. Переносчики дыхательной цепи сосредоточены на внутренней мембране митохондрий. При этом они как бы вплетены в митохондриальную мембрану и составляют дыхательные ансамбли. Так же как в мембранах хлоропластов, переносчики, расположенные в митохондриях, неоднородны. Одни из них переносят целые атомы водорода, а другие — лишь электроны. Использование переносчиков второго типа (переносящих электрон) возможно потому, что протоны (Н+) могут находиться в водной среде клетки в свободном состоянии. В мембране митохондрий, так же как и в мембране хлоропластов, переносчики водорода чередуются с переносчиками электрона, что имеет принципиальное значение для хемиосмотической теории. Молекула переносчика, несущая целый атом водорода, взаимодействует с переносчиком, воспринимающим только электроны, и протоны высвобождаются в межмембранное пространство. Именно это, согласно хемиосмотической теории, лежит в основе преобразования выделяющейся в процессе окисления энергии в энергию электрохимического мембранного потенциала — ∆μН+ и далее в энергию АТФ. Согласно теории Митчелла, при переносе пары электронов от НАД на кислород они пересекают мембрану 3 раза и этот перенос сопровождается выделением на внешнюю сторону мембраны 6 (3 пар) протонов.
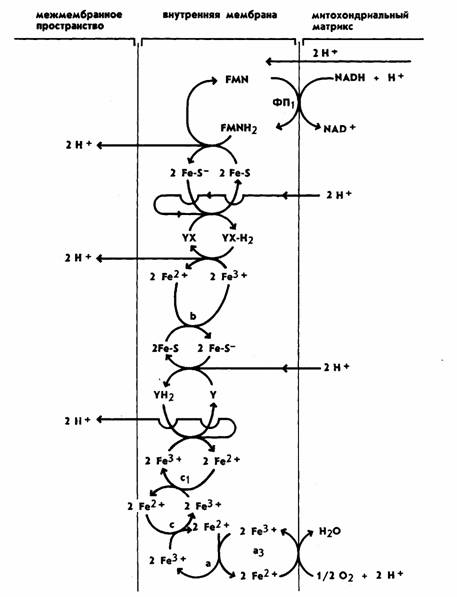
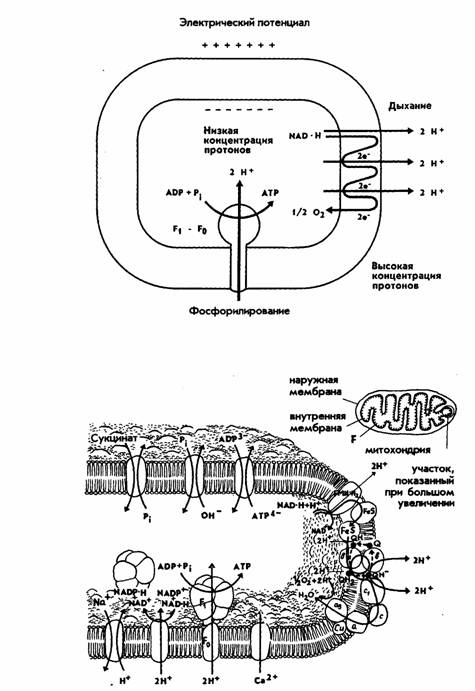
При рассмотрении рисунков надо учитывать, что это лишь предположительная схема расположения переносчиков. Многое в ней нуждается в уточнении. Как видно из приведенной схемы, восстановленный кофермент НАД·Н2,образующийся в реакциях цикла Кребса, располагается на внутренней стороне мембраны митохондрий. На первом этапе ФАД воспринимает водороды от НАД и восстанавливается, образуя ФАД·Н2. С помощью этого фермента 2Н+ переносятся на другую (внешнюю) сторону мембраны, и здесь происходит первое разделение зарядов. Два протона (2Н+) выделяются на внешнюю сторону внутренней мембраны, а электроны присоединяются к переносчику (железосерный белок), с помощью которого переносятся на внутреннюю сторону мембраны. При этом происходит восстановление железа (Fe3++e-→Fe2+). Этот переносчик переправляет электроны снова на внутреннюю сторону мембраны. Здесь электроны акцептируются KoQ (убихинон — переносчик Н), который, заряжаясь отрицательно, захватывает двумя электронами два протона из внутренней среды. Поскольку KoQ растворим в липидах, он диффундирует к внешней стороне мембраны и выделяет там еще 2Н+ (второе разделение зарядов), а электроны передаются на цитохром b. Рассматривая схему, мы указали на два места выделения (всего четырех) протонов. Между тем, согласно хемиосмотической теории, локализация пунктов фосфорилирования в дыхательной цепи определяется пунктами выделения ионов Н+. Поскольку, как указывалось выше, показано наличие трех мест фосфорилирования, то необходима транслокация через внутреннюю мембрану трех пар протонов. Однако точно место выделения третьей пары протонов не установлено. Предполагается, что третья пара Н+ выделяется также при переносе электронов от KoQ (убихинона) к цитохрому b. При этом участвуют 2 молекулы убихинона, которые сначала переходят в полухинон, а затем в гидрохинон (выделяется третья пара Н+). Далее электроны передвигаются по цепи цитохромов b, с, а, а3, содержащих железо. В каждом из них происходят обратимые окислительно-восстановительные превращения железа. На заключительном этапе электроны переносятся ферментом цитохромоксидазой (содержащей наряду с железом медь) на внутреннюю сторону мембраны на кислород. Кислород, заряжаясь, воспринимает 2Н+ из внутренней среды с образованием Н2О. В результате выброса ионов Н+ на внешнюю сторону мембраны митохондрий и создается электрохимический градиент протонов (∆μН+). Таким образом, сам механизм процессов, происходящих на мембранах хлоропластов и митохондрий, сходен. Однако имеются два основных отличия: 1) в случае хлоропластов источником энергии потока электронов служит энергия света, а у митохондрий — энергия окислительных процессов; 2) распределение протонов на мембране противоположно: у митохондрий протоны - накапливаются на наружной стороне, а у хлоропластов — на внутренней.
Протонный градиент представляет собой как бы резервуар свободной энергии. Эту энергию можно использовать при обратном потоке протонов через мембрану. При этом происходит разрядка мембраны. В частности, энергия может быть затрачена на синтез АТФ. Процесс синтеза АТФ идет с помощью специальных ферментов — АТФ-синтетаз (АТФ-азы). Этот фермент обратимого действия в зависимости от условий может осуществлять не только синтез АТФ с поглощением, но и ее гидролиз с выделением энергии. АТФ-азы локализованы на мембранах в виде грибовидных частиц, состоящих из «шляпки», выступающей на поверхности мембраны, и «ножки», погруженной в толщу мембраны. Активный участок фермента расположен в «шляпке», а «ножка» представляет собой канал, по которому осуществляется обратный — по градиенту концентрации ток протонов.
Существуют две гипотезы, объясняющие механизм синтеза АТФ прямой и косвенный. Согласно прямому механизму, АДФ и Фн связываются с активным центром фермента, куда по каналу поступают протоны. Два протона соединяются с кислородом фосфата с образованием Н2О. Это делает Фн активным, и он присоединяется к АДФ. После этого молекула АТФ отделяется от фермента. Согласно второй гипотезе, АДФ присоединяет молекулу Фн в активном центре фермента спонтанно. Однако образующаяся при этом молекула АТФ прочно связывается с ферментом, и для ее освобождения требуется энергия. Энергия доставляется протонами, которые, воздействуя на фермент, изменяют его конформацию, благодаря чему АТФ высвобождается.
Доказательством того, что именно градиент протона обеспечивает фосфорилирование, являются опыты с разобщителями окисления и фосфорилирования. Как уже упоминалось, к таким разобщителям относится динитрофенол. Оказалось, что действие динитрофенола связано с тем, что он делает мембрану проницаемой для протонов и тем самым ликвидирует протонный градиент. При этом скорость окисления даже усиливается, однако фосфорилирование не происходит. Таким образом, процесс окисления сопряжен с процессом фосфорилирования. Степень сопряженности окисления и фосфорилирования может быть разной в зависимости от условий и от состояния клеток. Показателем сопряженности окисления и фосфорилирования служит коэффициент фосфорилированияР/О. Это — отношение количества связанного неорганического фосфора (АДФ + Фн →АТФ) к поглощенному в процессе дыхания кислороду. Как уже рассматривалось выше, перенос двух электронов к кислороду по дыхательной цепи сопровождается не более чем тремя фосфорилированиями. Следовательно, коэффициент Р/О может быть не более 3. На величину Р/О оказывают влияние внешние условия. При засухе окисление усиливается, а накопление энергии в виде АТФ не происходит, коэффициент Р/О резко падает. Коэффициент фосфорилирования резко падает и при заболевании организмов.
В ряде случаев может наблюдаться непосредственное использование энергии протонного градиента (∆μН+). Действительно, поскольку внутренняя сторона мембраны оказывается заряженной отрицательно, возникает трансмембранный потенциал. Катионы в силу электрического притяжения могут поступать и накапливаться во внутреннем пространстве митохондрий. Имеются данные, что протонный градиент может обеспечить также приток углеводов, в частности поступление сахарозы в ситовидные трубки. Таким образом, ∆μН+ обеспечивает осмотическую работу и транспорт веществ против градиента их концентрации. Наконец, показана возможность использования ∆μН+ на механическую работу (движение бактерий). Вместе с тем важно отметить, что ∆μН+ может играть роль как транспортная форма энергии, передаваясь вдоль мембран (В. П. Скулачев).
Таким образом, клетка обладает двумя формами используемой энергии, двумя энергетическими «валютами» — АТФ и ∆μН+:
1) АТФ — химическая «валюта», растворимая в воде и легко используемая в водной фазе;
2) ∆μН+ — электрохимическая, неразрывно связанная с мембранами.
Важно заметить, что эти две формы используемой клеткой энергии могут переходить друг в друга. При образовании АТФ используется энергия ∆μН+. При распаде АТФ энергия может аккумулироваться в∆μН+.
Date: 2015-07-17; view: 1327; Нарушение авторских прав