
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Порядок виконання роботи
|
|
Лабораторна робота № 13
Тема: Загальні властивості розчинів
Мета роботи: навчитися визначати теплоту розчинення, теплоту гідратації, вивчити, як впливає зміна температура на розчинність різних сполук.
Порядок виконання роботи
1)Теплота розчинення. Налийте в пробірку 3…4 мл води та виміряйте її температуру. Додайте порцію (приблизно 1 г) хлориду амонію, обережно перемішайте. Виміряйте температуру розчину, що утворився. Зробіть висновок про те, який знак має ΔН розчинення.
Проведіть аналогічний дослід, використавши замість хлориду амонію гідроксид калію. Поясніть, чому ΔН розчинення NH4Cl та КОН мають протилежні знаки.
2)Теплота гідратації. У дві пробірки налийте по 3 мл води, виміряйте її температуру. В одну пробірку додайте порцію (приблизно 1г) безводного карбонату натрію, у другу – порцію кристалогідрату Na2CO3*10H2O, обережно перемішайте. Виміряйте температуру розчинів, що утворилися. Поясніть відмінність теплових ефектів розчинення безводної солі та кристалогідрату.
3)Вплив температури на розчинність. 1. До 3…4 мл насиченого розчину нітрату калію додайте трохи (0,5 г) кристалів цієї ж солі. Чи розчиняється сіль? Нагрійте розчин. Що відбувається під час нагрівання? Чому?
1) Наливаємо в пробірку 3…4 мл води та вимірюємо її температуру (tводи = 210С). При додаванні NH4Cl у воду спостерігаємо охолодження розчину (tр-ну = 140С), тобто розчинення відбулось з поглинанням теплоти, процес розчинення – ендотермічний.
Оскільки, ΔНрозч.= ΔНрозр.зв + ΔНсольв., а ΔНрозр.зв > 0, ΔНсольв. < 0, то знак ΔН розчинення залежить від того, яка з цих складових дає більший внесок у загальне значення теплоти розчинення. Оскільки процес розчинення ендотермічний, то ΔНрозр.зв дає більший внесок, тому ΔНрозч. > 0.
tводи = 210С. При додаванні КОН спостерігаємо підвищення температури (tр-ну = 260С), розчинення відбулося з виділенням теплоти, процес розчинення екзотермічний, ΔНрозч. < 0, а це означає, що ΔНсольв. дає більший внесок.
2) У дві пробірки наливаємо по 3 мл води, виміряємо її температуру (tводи = 210С). При розчиненні безводного Na2CO3
температура системи підвищується (tр-ну = 240С), тобто ΔНрозчин.< 0, а це означає, що ΔНсольв.переважає над ΔНрозр.зв.
При розчиненні кристалогідрату, у якого сольватація вже відбулась, (ΔНсольв 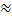 0), температура знижується, ΔНрозр.зв
0), температура знижується, ΔНрозр.зв 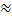 ΔНрозчин., ΔНрозчин. > 0.
ΔНрозчин., ΔНрозчин. > 0.
3) 1. При додаванні кристалів солі до 3…4 мл насиченого розчину нітрату калію, вони не розчинилися. При нагріванні спостерігаємо розчинення солі. Отже, розчинність солі KNO3 зростає з підвищенням температури.
2. Нагрійте 2 мл насиченого розчину ацетату кальцію. Поясніть причину утворення кристалів.
Date: 2016-07-25; view: 277; Нарушение авторских прав