
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Координационные соединения. Центральный атом и лиганды, внутренняя и внешняя сферы комплексных соединений, координационное число.
|
|
Теория Вернера 1893г.
После открытия периодического закона Менделеева, это самое крупное открытие в общей неорганической химии.
Суть:
Вернер разделил все соединения на 2 типа:
1) «простые»
2) комплексные (кристаллогидраты, аммиакаты, двойные соли)
В комплексных соединениях Вернер выделил две сферы – внутреннюю и внешнюю.
Во внутренней сфере находятся частицы, очень прочно связанные между собой.
Внутреннюю сферу обычно заключают в квадратные скобки, поэтому комплексы иногда называют соединениями в квадратных скобках.
Примеры: [Cr(H2O)6]Cl3, [Co(NH3)6]Cl3, Na3[AlF6], [Pt(NH3)2Cl2], [Ni(CO)4] (внутренняя сфера комплексных соединений выделена квадратными скобками и жирным шрифтом).
Внутреннюю сферу образуют центральный ион или центральный атом и координированные около него анионы или нейтральные молекулы.
Координированные частицы позднее стали называть лигандами (от лат. ligare – связывать).
В комплексах [Cr(H2O)6]Cl3, [Co(NH3)6]Cl3, Na3[Al F6 ], [Pt(NH3)2 Cl 2], [Ni(CO)4]
центральные ионы выделены жирным шрифтом, а лиганды – курсивом.
Ионы внешней сферы нейтрализуют заряд внутренней сферы.
В комплексах [Cr(H2O)6]Cl3, [Co(NH3)6]Cl3, Na3[AlF6] ионы внешней сферы выделены жирным шрифтом. В комплексах [Pt(NH3)2Cl2] и [Ni(CO)4], внешней сферы нет, так как внутренняя сфера не заряжена.
Комплексные соединения – соединения, образующиеся с участием донорно-акцепторной связи между комплексообразователем, предоставляющим для образования связи вакантные орбитали, и лигандами, предоставляющими для образования связи неподеленные электронные пары.
Внешняя сфера при растворенни диссоциирует нацело, а внутренняя – частично и ступенчато.
Координационной соединения – соединения, которые образуются в результате присоединения к иону-комплексообразователю нейтральных молекул и ионов.
Классификация:
- электролитного типа (катионного, анионного, смешанного)
- неэлектролитного типа
Лиганды – доноры неподеленных электронных пар, в комплексных соединениях связаны с комплексообразователем донорно-акцепторными связями. (нейтральные или отрицательно заряжены)
СO, NO – нейтральные лиганды.
OH – отрицательные лиганды (ацидо-лиганды)
Координационное число – число атомов лигандов, непосредственно контактирующих с центральным атомом.
Координационное соединение устойчиво в водных растворах и не распадается или распадается в незначительной степени.
39. Строение координационных соединений, гибридизация орбиталей центрального атома.
В пространстве координационные соединения имеют форму многогранников - координационных полиэдров, в вершинах к-рых располагаются атомы лигандов, непосредственно связанные с центр. атомом, или неподеленные электронные пары последнего.
 Комплексы с к. ч. 2, напр. [CuCl2]-, [Ag(CN)2]-, имеют линейное строение, для к. ч. 3 возможно строение плоского равностороннего треугольника, как, напр., [HgI3]- (ф-ла VI) или [Pd(PPh3)3], или тригональной пирамиды. В случае к. ч. 4 наиб. часто встречаются конфигурации плоского квадрата, напр. [Pt(NH3)2Cl2] (VII), или тетраэдра, напр. [BF4]-, [BeF4]2- (VIII). Для к. ч. 5 координац. полиэдрыквадратная пирамида, напр. [Ni(PR3)2Br3] (IX), или тригональная бипирамида, напр. [Fe(CO)5] (X). При к. ч. 6 координац. полиэдр обычно октаэдр, напр. [PF6]- (XI), [PtCl6]2-, однако иногда встречается и конфигурация тригональной призмы. Для к. ч. 7 известны конфигурации пентагональной бипирамиды, напр. [ZrF7]3-, [UF7]3- (XII), гранецентрир. тетрагональной призмы, напр. [NbF7]2-, или др. В случае к. ч. 8 координац. полиэдры - квадратная антипризма, напр. [TaF8]3- (XIII), или додекаэдр, напр. [Mo(CN)8]4-. Для к. ч. 9 наблюдается конфигурация гранецентрир. тригональной призмы, к-рая наиб. широко известна для аквакомплексов лантаноидов, напр. [Nd(H2O)9]3+. В случае к. ч. 10 обнаружены конфигурации додекаэдра с раздвоенными вершинами для [Nd(Me2SO4)4(NO3)3] и двушапочной антипризмы для {[Th(H2O)2(HCOO)4].H2O}.
Комплексы с к. ч. 2, напр. [CuCl2]-, [Ag(CN)2]-, имеют линейное строение, для к. ч. 3 возможно строение плоского равностороннего треугольника, как, напр., [HgI3]- (ф-ла VI) или [Pd(PPh3)3], или тригональной пирамиды. В случае к. ч. 4 наиб. часто встречаются конфигурации плоского квадрата, напр. [Pt(NH3)2Cl2] (VII), или тетраэдра, напр. [BF4]-, [BeF4]2- (VIII). Для к. ч. 5 координац. полиэдрыквадратная пирамида, напр. [Ni(PR3)2Br3] (IX), или тригональная бипирамида, напр. [Fe(CO)5] (X). При к. ч. 6 координац. полиэдр обычно октаэдр, напр. [PF6]- (XI), [PtCl6]2-, однако иногда встречается и конфигурация тригональной призмы. Для к. ч. 7 известны конфигурации пентагональной бипирамиды, напр. [ZrF7]3-, [UF7]3- (XII), гранецентрир. тетрагональной призмы, напр. [NbF7]2-, или др. В случае к. ч. 8 координац. полиэдры - квадратная антипризма, напр. [TaF8]3- (XIII), или додекаэдр, напр. [Mo(CN)8]4-. Для к. ч. 9 наблюдается конфигурация гранецентрир. тригональной призмы, к-рая наиб. широко известна для аквакомплексов лантаноидов, напр. [Nd(H2O)9]3+. В случае к. ч. 10 обнаружены конфигурации додекаэдра с раздвоенными вершинами для [Nd(Me2SO4)4(NO3)3] и двушапочной антипризмы для {[Th(H2O)2(HCOO)4].H2O}.
Теория валентных связей предполагает гибридизацию орбиталей центрального атома. Расположение образующихся при этом гибридных орбиталей определяет геометрию комплексов.
Диамагнитный комплексный ион Fe(CN)64-.
Цианид-ион – донор

Ион железа Fe2+ – акцептор – имеет формулу 3d64s04p0. С учетом диамагнитности комплекса (все электроны спарены) и координационного числа (нужны 6 свободных орбиталей) имеем d2sp3 -гибридизацию:
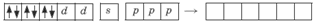
Комплекс диамагнитный, низкоспиновый, внутриорбитальный, стабильный (не используются внешние электроны), октаэд-рический (d2sp3 -гибридизация).
Парамагнитный комплексный ион FeF63-.
Фторид-ион – донор.
Ион железа Fe3+ – акцептор – имеет формулу 3d54s04p0. С учетом парамагнитности комплекса (электроны распарены) и координационного числа (нужны 6 свободных орбиталей) имеем sp3d2 -гибридизацию:

Комплекс парамагнитный, высокоспиновый, внешнеорбитальный, нестабильный (использованы внешние 4d-орбитали), октаэдрический (sp3d2 -гибридизация).
Date: 2016-07-20; view: 497; Нарушение авторских прав