
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Реакцию синтеза аммиака проводят при объемном (молярном) соотношении
Всероссийская олимпиада школьников по химии
Год.
II (муниципальный этап)
Класс.
Решения
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Al4C3 C4H9Cl
1 ↓2 3 4 5 6 ↑7 8
СН3СООК→ Х1 →СН3Cl→ Х2 →C2H5Br→ Х3 →CH3COOH
↓9 ↓10
СН3OH C2H4 (10 баллов)
1. СН3СООК + KOH → СН4↑ + K2CO3 (toC) (реакция Дюма) 1 балл
2. Al4C3 +12H2O → 4Al(OH)3↓ + 3СН4↑ 1 балл
Al4C3 +12HCl → 4AlCl3 + 3СН4↑
Al4C3 + 4NaOH + 12H2O → 4Na[Al(OH)4] + 3СН4↑
3. СН4 + Cl2 → СН3Cl + HCl (hν) 1 балл
4. 2СН3Cl + 2Na → C2H6↑ + 2NaCl (toC) (реакция Вюрца) 1 балл
5. С2Н6 + Br2 → С2Н5Br + HBr (hν) 1 балл
6. 2C2H5Br + 2Na → C4H10↑ + 2NaCl (toC) (реакция Вюрца) 1 балл
7. СН3‒СН2‒СН2‒СН3 + Сl2 → CH3‒CH(Cl)‒CH2‒CH3 + HCl (hν) 1 балл
2‒хлорбутан
В алканах наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного.
8. -3 -2 -2 -3 0 -3 +3 -2
2СH3‒CH2‒CH2‒CH3 + 5O2 → 4CH3COOH + 2H2O (to, p, kat) (реакция Эмануэля)
↓ ↓ ↑ уксусная (этановая) кислота
5е + 5е = 10е/2 2е∙2/5 вос-е, ок-ль
ок-е, вос-ль 1 балл
9. 2CH4 + O2 → 2СН3OH (to, p, kat) 1 балл
10. H3C-CH3 → H2C=CH2↑ + H2↑ (to, kat) 1 балл
Баллов
2. К смеси меди и оксида меди (I) массой 17,92 г прилили 192 мл 14%-го раствора серной кислоты (ρ = 1,095 г/мл) и пропустили кислород при нагревании. Масса раствора после окончания реакций увеличилась на 2,88 г. Вычислите массовые доли компонентов в исходной смеси и массовые доли веществ в растворе. (10 баллов)
Масса раствора увеличилась за счет кислорода, вступившего в реакцию окисления меди и оксида меди(I) в присутствии серной кислоты.
ν(О2) = 2,88 г / 32 г/моль = 0,09 моль 1 балл
х моль 2х моль 0,5х моль 2х моль
2Cu2O + 4H2SO4 + O2 = 4CuSO4 + 4H2O 1 балл
2 моль 4 моль 1 моль 4 моль
144 г/моль 98 г/моль 32 г/моль 160 г/моль
у моль у моль 0,5у моль у моль
2Cu + 2H2SO4 + O2 = 2CuSO4 + 2H2O 1 балл
2 моль 2 моль 1 моль 2 моль
64 г/моль
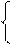 | 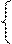 | 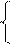 |
144х + 64у = 17,92 144х + 64у = 17,92 х = 0,08
0,5х + 0,5у = 0,09 (128) 64х + 64у = 11,52 у = 0,1
ν((Cu2O) = 0,08 моль
ν(Cu) = 0,1 моль 2 балла
ω%(Cu2O) = (0,08 моль ∙ 144 г/моль / 17,92 г) ∙ 100% = 64,29% 0,5 балла
ω%(Cu) = (0,1 моль ∙ 64 г/моль / 17,92 г) ∙ 100% = 35,71% 0,5 балла
Находим количество вещества прилитой серной кислоты:
ν(H2SO4) = (192 мл ∙ 1,095 г/мл ∙ 0,14) / 98 г/моль = 0,3 моль 1 балл
В реакции вступило (2 ∙ 0,08 + 0,1) = 0,26 моль серной кислоты,
а (0,3 – 0,26) = 0,04 моль серной кислоты в избытке. 0,5 балла
m(конечного раствора) = m(смеси) + m(раствора H2SO4) + m(О2)
m(конечного раствора) = 17,92 г + 192 мл ∙ 1,095 г/мл + 2,88 г = 231,04 г 1 балл
ω%(CuSO4) = ((2∙0,08 + 0,1) моль ∙ 160 г/моль / 231,04 г) ∙ 100% = 18,01% 0,5 балла
ω%(Н2SO4) = (0,04 моль ∙ 98 г/моль / 231,04 г) ∙ 100% = 1,70% 0,5 балла
ω%(Н2O) = 100% - (18,01% + 1,70%) = 80,29% 0,5 балла
Баллов
3. При сплавлении 9,45 г калиевой соли предельной одноосновной карбоновой кислоты с гидроксидом калия выделилось 3,3 г предельного углеводорода.
Определите молекулярные формулы соли и ее изомеров, предельного углеводорода, назовите их. Напишите уравнения реакций электролиза водных растворов солей (электросинтез Кольбе), назовите продукты реакций. (10 баллов)
CnH2n+1COOК + КOH → CnH2n+2 + К2CO3 1 балл
1 моль 1 моль
(14n + 84) г/моль (14n + 2) г/моль
ν(CnH2n+1COOК) = ν(CnH2n+2) 1 балл
9,45 / (14n + 84) = 3,3 / (14n + 2) 1 балл
132,3n + 18,9 = 46,2n + 277,2
86,1n = 258,3 n = 3 1 балл
CH3CH2CH2COOК – калиевая соль бутановой кислоты, бутаноат калия, бутират калия, маслянокислый калий 1 балл
СН3СН(СН3)СООК – калиевая соль изобутановой кислоты, 2-метилпропаноат калия
1 балл
CH3-CH2-CH3, C3H8 – пропан 1 балл
2С3Н7СООК + 2Н2О → С6Н14 + 2СО2↑ + Н2↑ + 2КОН (электролиз) 1 балл
гексан
2СН3СН(СН3)СООК + 2Н2О → СН3СН(СН3)СН(СН3)СН3 + 2СО2↑ + Н2↑ + 2КОН
2,3-диметилбутан (электролиз)
2 балла
Баллов
4. В пяти пронумерованных пробирках имеются растворы гидрокарбоната бария, нитрата цинка, сульфата железа (II), хлорида аммония и нитрата марганца (II). Используя только один реагент, определите содержимое каждой пробирки. Напишите уравнения реакций (молекулярные, краткие ионные и окислительно-восстановительные). Укажите признаки реакций. (14 баллов)
| NaOH или KOH // признаки реакций | |
| Ва(НСO3)2 | ↓ ВаСО3 белый |
| Zn(NO3)2 | ↓ Zn(ОН)2 белый, растворимый в избытке щелочи |
| FeSO4 | ↓ Fe(ОН)2 белозеленый (зеленоватый, грязно-зеленый), буреющий на воздухе |
| NH4Cl | ↑ NH3 запах аммиака |
| Mn(NO3)2 | ↓ Mn(ОН)2 телесный (белый с розовым оттенком), темнеющий на воздухе |
Ва(НСO3)2+ 2NaOH = ВаСО3↓ + Na2СO3 + 2Н2О 0,5 балла
Ва2+ + 2НСO3-+ 2OH- = ВаСО3↓ + СO32- + 2Н2О 0,5 балла
Zn(NO3)2 + 2NaOHнедост. = Zn(OH)2↓+ 2NaNO3 0,5 балла
Zn2+ + 2OH- = Zn(OH)2↓ 0,5 балла
Zn(OH)2 + 2NaOHизб. = Na2[Zn(OH)4] 0,5 балла
Zn(OH)2 + 2OH- = [Zn(OH)4]2- 0,5 балла
или
Zn(NO3)2 + 4NaOHизб. = Na2[Zn(OH)4] + 2NaNO3
Zn2+ + 4OH- = [Zn(OH)4]2-
FeSO4 + 2NaOH = Fe(ОН)2↓ + Na2SO4 0,5 балла
Fe2+ + 2OH- = Fe(ОН)2↓ 0,5 балла
+2 0 +3 -2
4Fe(ОН)2 + O2 + 2H2O = 4Fe(ОН)3↓ 1 балл
↓ ↑
1е/1 2е∙2/1 вос-е, ок-ль
ок-е, вос-ль
NH4Сl+ NaOH = NH3↑ + NaCl + H2O 0,5 балла
NH4+ + OH- = NH3↑ + H2O 0,5 балла
Mn(NO3)2 + 2NaOH = Mn(ОН)2↓ + 2NaNO3 0,5 балла
Mn2+ + 2OH- = Mn(ОН)2↓ 0,5 балла
+2 0 +4 -2
2Mn(ОН)2 + O2 = 2MnO2↓+ 2H2O или 4Mn(ОН)2 + O2 = 4MnО(ОН)↓+ 2H2O
↓ ↑ 1 балл
2е/2 2е∙2/1 вос-е, ок-ль
ок-е, вос-ль
за выбор реактива – гидроксид калия или гидроксид натрия – 1 балл
за предложенный рациональный план 1 балл
за указание признаков реакций по 0,5 балла (0,5 ∙ 8 = 4 баллов)
Баллов
5. Напишите уравнения реакций (молекулярные, сокращенные ионные и окислительно- восстановительные), с помощью которых можно осуществить следующие превращения, укажите условия протекания реакций:
7 8
Fe(NO3)2→(FeFe2)O4-(HI)→X1
1 2 3 4 ↑6 5
N2→NH3→NO→NO2→HNO3→NH4NO3
↓9
(NH2)2CO (мочевина, карбамид) (11 баллов)
1. N2 + 3H2 ↔ 2NH3↑ + Q (to, p, kat.:Fe) (OBP)
Равновесие реакции синтеза аммиака смещено вправо при следующих условиях:
1. t2 < t1 (понижение температуры, т.к. прямая реакция экзотермическая)
2. p2 > p1 (повышение давления, т.к. прямая реакция идет с уменьшением объема)
3. c2(NH3) < c1(NH3) (понижение концентрации аммиака)
Реакцию синтеза аммиака проводят при объемном (молярном) соотношении
азота и водорода 1: 3. 2 балла
2. 4NH3 + 5O2 = 4NO↑ + 6H2O (to, kat.:Pt) (OBP) 1 балл
3. 2NO + O2 ↔ 2NO2↑ + Q (OBP)
Равновесие реакции окисления оксида азота (II) смещено вправо при следующих условиях:
1. t2 < t1 (понижение температуры, т.к. прямая реакция экзотермическая)
2. p2 > p1 (повышение давления, т.к. прямая реакция идет с уменьшением объема)
3. c2(O2) > c1(O2) (повышение концентрации кислорода) 2 балла
4. 4NO2 + O2 + 2H2O = 4HNO3 + Q (OBP) 1 балл
Реакционную смесь охлаждают, чтобы избежать разложения азотной кислоты.
4HNO3 = 4NO2↑ + O2↑ + 2H2O (> 82oC)
5. HNO3 + NH3 = NH4NO3 + Q 1 балл
H+ + NH3 = NH4+
6. 4Fe + 10HNO3 очень разб. = 4Fe(NO3)2 + NH4NO3 + 3H2O (OBP) 1 балл
7. 3Fe(NO3)2 = (FeFe2)O4 + 6NO2↑ + O2↑ (toC) (OBP) 1 балл
8. (FeFe2)O4 + 8HI = 3FeI2 + I2↓ + 4H2O (OBP) 1 балл
9. 2NH3 + CO2 = (NH2)2CO + H2O (180-500oC, p) C(NH2)2О, CО(NH2)2 1 балл
Баллов
6. При полном окислении бутана кислородом выделилось 201,60 кДж теплоты. Теплота сгорания бутана равна 2880 кДж/моль. Образовавшийся углекислый газ полностью реагирует с 196,00 г 14,00%-го раствора гидроксида калия. Вычислите массовые доли веществ в растворе. (11 баллов)
I способ
С4Н10 + 6,5О2 = 4СО2↑ + 5Н2О + 2880 кДж 1 балл
1 моль 4 моль
ν(СО2) = 4ν(С4Н10) = 4(201,600 кДж / 2880 кДж/моль) = 0,28 моль 1 балл
ν(КОН) = (196,000 г ∙ 0,14) / 56 г/моль = 0,49 моль 1 балл
ν(СО2): ν(КОН) = 0,28: 0,49 = 1: 1,75 = 4: 7
КНСО3 1 < 1,75 < 2 К2СО3 → образуются карбонат и гидрокарбонат калия
1 балл
0,245 моль 0,49 моль 0,245 моль
СО2 + 2КОН = К2СО3 + Н2О 1 балл
1 моль 2 моль 1 моль
В реакцию с карбонатом калия вступит (0,28 – 0,245) = 0,035 моль углекислого газа
0,035 моль 0,035 моль 0,07 моль
К2СО3 + СО2 + Н2О = 2КНСО3 1 балл
1 моль 1 моль 2 моль
138 г/моль 100 г/моль
В растворе: ν(КHСO3) = 0,07 моль; ν(К2СO3) = 0,245 – 0,035 = 0,21 моль 1 балл
m(раствора солей) = m(раствора КOH) + m(СO2)
m(раствора солей) = 196 г + (0,28 моль ∙ 44 г/моль = 208,32 г 1 балл
ω%(К2СO3) = (0,21 моль ∙ 138 г/моль / 208,32 г) ∙ 100% = 13,91% 1 балл
ω%(КHСО3) = (0,07 моль ∙ 100 г/моль / 208,32 г) ∙ 100% = 3,36% 1 балл
ω%(H2O) = 100% - (13,91% + 3,36%) = 82,73% 1 балл
Баллов
II способ
С4Н10 + 6,5О2 = 4СО2↑ + 5Н2О + 2880 кДж 1 балл
1 моль 4 моль
ν(СО2) = 4ν(С4Н10) = 4(201,6 кДж / 2880 кДж/моль) = 0,284 моль 1 балл
ν(КОН) = (196 г ∙ 0,14) / 56 г/моль = 0,49 моль 1 балл
ν(СО2): ν(КОН) = 0,28: 0,49 = 1: 1,75 = 4: 7
КНСО3 1 < 1,75 < 2 К2СО3 → образуются карбонат и гидрокарбонат калия
1 балл
0,28 моль 0,49 моль 0,21 моль 0,07 моль
4СO2 + 7КОН = 3К2СO3 + КHСO3 + 4H2O 2 балла
4 моль 7 моль 3 моль 1 моль
138 г/моль 100 г/моль
В растворе: ν(КHСO3) = 0,07 моль; ν(К2СO3) = 0,21моль 1 балл
m(раствора солей) = m(раствора КOH) + m(СO2)
m(раствора солей) = 196 г + (0,28 моль ∙ 44 г/моль = 208,32 г 1 балл
ω%(К2СO3) = (0,21 моль ∙ 138 г/моль / 208,32 г) ∙ 100% = 13,91% 1 балл
ω%(КHСО3) = (0,07 моль ∙ 100 г/моль / 208,32 г) ∙ 100% = 3,36% 1 балл
ω%(H2O) = 100% - (13,91% + 3,36%) = 82,73% 1 балл
Баллов
При правильном решении любым способом – 11 баллов
7. Аммиак, выделившийся при взаимодействии 102,9 мл 12%-го раствора сульфата аммония (ρ = 1,069 г/мл) с 20,52 г гидроксида бария, полностью поглотили 95,10 г
10%-го раствора хлорида хрома (III). Какова массовая доля хлорида аммония в полученном растворе? (9 баллов)
0,1 моль 0,1 моль 0,2 моль
(NH4)2SO4 + Вa(OH)2 = 2NH3↑ + ВaSO4↓ + 2H2O 1 балла
1 моль 1 моль 2 моль
132 г/моль 171 г/моль 17 г/моль
ν((NH4)2SO4) = (102,9 мл ∙ 1,069 г/мл ∙ 0,12) / 132 г/моль = 0,1 моль 1 балл
ν(Вa(OH)2) = 20,52 / 171 г/моль = 0,12 моль 1 балл
0,1 / 1 < 0,12 /1, гидроксид бария в избытке, расчет производим по сульфату аммония
0,18моль 0,06 моль 0,18 моль 0,06 моль
3NH3 + 3H2O + CrCl3 = 3NH4Cl + Cr(OH)3↓ 1 балл
3 моль 1 моль 3 моль 1 моль
158,5 г/моль 53,5 г/моль 103 г/моль
ν(CrCl3) = (95,1 г ∙ 0,1) / 158,5 г/моль = 0,06 моль 1 балл
0,06/1 < 0,2/3, аммиак в избытке, расчет производим по хлориду хрома (III)
NH3 + H2O = NH3.H2O (0,02 моль аммиака в избытке) 1 балл
m(раствора после реакции) = m(NH3) + m(раствора СrCl3) - m(Cr(OH)3)
m(раствора) = 0,2 моль ∙ 17 г/моль + 95,1 г - 0,06 моль ∙ 103 г/моль = 92,32 г 2 балла
ω%(NH4Сl) = (0,18 моль ∙ 53,5 г/моль / 92,32 г) ∙ 100% = 10,43% 1 балл
Баллов
Всего: 75 баллов
| <== предыдущая | | | следующая ==> |
| III. Расчет себестоимости изделия и реклама | | | Пояснювальна записка |
Date: 2016-07-18; view: 516; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |