
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Движущая сила массопередачи. Способы выражения состава фаз
|
|
Для отдающей фазы движущей силой массопередачи является разность рабочей и равновесной концентраций (долей) распределяемого компонента. Для принимающей фазы движущая сила массопередачи – разность равновесной и рабочей концентраций (долей) этого компонента. Следовательно, отрезки aaу и aaх на рис. 4.7 графически отображают значения текущих движущих сил в точке а рабочей линии для газовой, Δуа (кмоль компонента/кмоль газовой фазы), и жидкой, Δха (кмоль компонента/кмоль жидкости): Δуа=уа-уа*; Δха=ха*-ха Согласно приведенному рисунку движущие силы на входе газовой фазы в аппарат по газовой и жидкой фазе Δун и Δун соответственно: Δун=ун-ун*; Δхн=хн*-хн. Для выхода газовой фазы из аппарата движущие силы по газовой и жидкой фазе Δук и Δук соответственно: Δук=ук-ук*; Δхк=хк*-хк. На рисунке дан пример для противоточного аппарата, в котором газовая фаза является отдающей, а жидкая – принимающей. Для упрощения восприятия рабочая и равновесная линии приняты прямыми. Как видно из рисунка, рабочая линия лежит выше равновесной, так как газовая фаза является отдающей. Точка a на рабочей линии AB характеризует некие промежуточные взаимосвязанные действующие (рабочие) молярные доли распределяемого компонента в жидкой и газовой фазах ха и уа соответственно.

Проведя через точку a горизонталь до линии равновесия у*=f(x), на пересечении с ней получим точку ax Абсцисса этой точки характеризует ха* – молярную долю распределяемого компонента в жидкости, равновесной с газовой фазой, молярная доля распределяемого компонента в которой уа. Проведя через точку a вертикаль, в месте пересечения ее с линией
равновесия получим точку ay. Ордината этой точки характеризует уа – молярную долю распределяемого компонента в газовой фазе, равновесной с жидкостью, молярная доля распределяемого компонента в которой ха. То, что уа >уа*; ха<ха* является доказательством того, что компонент переходит из газовой фазы в жидкую (газовая фаза – пересыщенная, жидкая – ненасыщенная).
Если рабочая и равновесная линии массообменного процесса являются прямыми, то средняя движущая сила массопередачи может быть рассчитана по следующим формулам:  ;
; 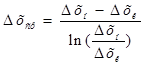
Способы выражения состава фаз. В массообменных процессах обычно приходится иметь дело не с чистыми компонентами, а с их смесями в разных фазах. Количественный состав фаз обычно выражают через объемные массовые или мольные концентрации. Объемные концентрации – кол-во кг или кмоль в ед объема фазы.  ,
, 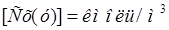 . х - содержание компонента в жидкой фазе; у - содержание компонента в газовой фазе.
. х - содержание компонента в жидкой фазе; у - содержание компонента в газовой фазе.
Массовые и мольные концентрации – отношение кол-ва данного компонента к кол-ву всей фазы. ( ;
;  )
)
Относительные массовые и мольные концентрации – отношениекол-ва данного компонента к кол-ву инертного носителя, кот не участвует в процессе переноса и кол-ва, кот. остается неизменным. ( ;
;  ).
).
Пусть смесь состоит из компонентов A, B, C,…,K,…,N, массовые доли (проценты) которых в смеси  и мольные массы (кг/кмоль) компонентов равны MA,MB,MC,…,MK,…,MN. Число моль любого компонента, например компонента К, на 1 кг смеси составляет
и мольные массы (кг/кмоль) компонентов равны MA,MB,MC,…,MK,…,MN. Число моль любого компонента, например компонента К, на 1 кг смеси составляет 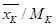 . Соответственно, кол-во этого компонента в смеси (в мол. долях) равна
. Соответственно, кол-во этого компонента в смеси (в мол. долях) равна  . Если пересчитать наоборот, это значит выразить массовые доли
. Если пересчитать наоборот, это значит выразить массовые доли  компонентов через мольные
компонентов через мольные 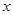 , получим
, получим 
76. Правило фаз Гиббса. Его практические приложения (?применения?)
При взаимодействии фаз системы происходит обмен веществом и энергией (массо- и теплообмен) через поверхность раздела фаз. При этом система стремится к состоянию равновесия и скорости перехода компонента с одной фазы в другую выравниваются. Система при равновесии может существовать до того времени, пока какое-нибудь внешнее воздействие не выведет ее из состояния равновесия (изменение температуры, давления). Если известны параметры равновесия, то можно установить границы, в которых могут происходить массообменные процессы. Состояние равновесия характеризуется правилом фаз: Ф + С = К + 2 (3.3) где Ф - число фаз; С - число степеней свободы (число независимых переменных, которое можно менять в определенных границах без нарушения числа и состава фаз в системе); К - число компонентов системы. В качестве степеней свободы системы могут быть температура, давление, концентрация компонента. Рассмотрим процесс абсорбции, когда система составляется из 2-х фаз газ - жидкость, а газовая фаза, кроме инертного компонента, содержит компонент, который поглощается жидкостью. Тогда Ф = 2, К = 3 (вещество, которое переходит из одной фазы в другую, и двух в-в - носителей. Подставим Ф и К в выражение (3.3), получим С = 3. В этом случае можно произвольно менять давление (p), температуру (t) и концентрацию одной из фаз по поглощенному компоненту (хА или уА). Т. о., при t = const, p = const концентрации одной из фаз соответствует определенная концентрация второй фазы. Ректификация: Для двухкомпонентной системы, которая состоит из паровой и жидкой фаз, Ф = 2, К = 2 и соответственно выражению (3.3), С = 2. В данном случае при p = const с изменением концентрации фазы (хА) должна меняться температура. Если однокомпонентная система находится одновременно в трех фазах: жидкой, твердой и паровой, тогда Ф = 3, К = 1 и С = 0. В этом случае параметры равновесия определены. Вода, лед и пар могут находиться в равновесии при t = 0,0076°С, p = 610,6 кПа. Правило фаз дает только
качественную оценку равновесной системы. Необходимые для изучения и теоретического расчета процессов массообмена количественные соотношения (иx составы) в равновесных системах в большинстве случаев не поддаются теоретическому расчету, а определяются по экспериментальным данным и приводятся в разных справочниках. По этим данным строится в принятой системе координат равновесная линия, которая характеризует зависимость между граничными концентрациями в-ва в фазах при заданных t и p. В общем виде связь между концентрациями распределенного вещества в фазах выражается зависимостью  или
или  . Эти ур-ия показывают, что значению концентрации в-ва в жидкой фазе (
. Эти ур-ия показывают, что значению концентрации в-ва в жидкой фазе (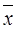 ) соответствует строго определенная концентрация в фазе (
) соответствует строго определенная концентрация в фазе ( ), и наоборот.
), и наоборот.
Линия равновесия может иметь разный вид в зависимости от системы. Например, для системы газ-жидкость (процесс абсорбции) зависимость равновесной концентрации в газовой фазе от концентрации в жидкостной фазе при Р = const и t = const показано на рис. 3.1, а, а на рис. 3.1, бы - равновесные кривые для системы пар - жидкость (процесс ректификации).

Отношения концентраций фаз при равновесии называются коэффициентом распределения:  .
.
Date: 2016-07-18; view: 1277; Нарушение авторских прав