
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Муниципальный этап Всероссийской олимпиады школьников по химии
При подготовке заданий муниципального этапа были использованы следующие источники информации:
Сорокин В.В., Загорский В.В., Свитанько И.В. Задачи химических олимпиад:
http://www.chem.msu.su/rus/school/sorokin/welcome.html
Примеры заданий с решениями:
http://www.chem.msu.su/rus/olimpiad/59/theor09.html
http://iumka.ru/himiya/olimpiada/item/10536/
http://him.1september.ru/view_article.php?ID=200802102. Методические основы подготовки к олимпиадам по химии
http://lib.repetitors.eu/himiya/159-2010-07-16-04-14-33/2033
8 класс 2015 год
ЗАДАНИЯ С РЕШЕНИЯМИ
Задача 8-1. Химический элемент X обнаружен на Солнце и в метеоритах, менее 1% Х содержится в минеральных породах на территории всех стран. Его кристаллы построены так же, как кристаллы алмаза и почти такие же хрупкие, как стекло, а его слиток стоит примерно столько же, сколько золотой. X образует с хлором соединение A, в котором 66,17% хлора. Молекулярное соединение A получают при «сгорании» элемента X в хлоре. Оксид B с такой же степенью окисления получают при сильном нагревании элемента X в атмосфере кислорода. При обработке оксида B концентрированным раствором соляной кислоты получают соединение A.
1) Определите элемент Х
2) Сколько электронов у атома элемента X на внешнем слое?
3) Сколько нейтронов в атоме элемента X?
4) Выведите формулу А и рассчитайте его молярную массу.
5) Опишите строение молекулы А. Объясните это строение с точки зрения теории химической связи.
6) Напишите уравнения реакций:– X + Cl2 →
X + O2 →
7) Напишите уравнение обработки оксида B концентрированным раствором соляной кислоты
8) Заполните пропуски в цитате: «... этот еще не открытый элемент должен был стать своеобразным «замком», связывающим два типичных неметалла -... с двумя типичными металлами -...»...». Чья это цитата?
Решение:
| № вопросов | Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | баллы |
| "кристаллы построены так же как и кристаллы алмаза" - значит, то же число валентных электронов, т.е. находится в 4 гр. гл. подгруппе. Значит, формула высшего хлорида ХСl4. | 1 б | |
| у атома элемента на внешнем слое 4 электрона | 1 б | |
| нейтронов в атоме элемента – 73-32=41 (для изотопа 73Ge) | 1б | |
| Масса хлора в 100 г хлорида = 66,17 г Атомная масса неизвестного элемента =Х Формула высшего хлорида ХСl4 Молярная масса хлорида М = Х + 4 ∙ 35,5 в 100 г - 66,17 г хлора в М - 4 ∙ 35,45 г хлора найдем М =214,599; ⇒Аr=72,5; ⇒Х=Ge (германий), формула А – GeCl4; М =214,4 (214,3) | 2б | |
Так как А – молекулярное соединение, подобное соединению углерода, то связь ковалентная полярная
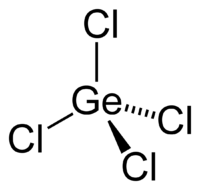 пространственная форма - тетраэдр пространственная форма - тетраэдр
| 1 б 2 б | |
| 6 | Ge + 2Cl2→ GeCl4 Ge + O2 →GeO2 | 1б 1б |
| 7 | GeO2 +4 HCl → GeCl4 +2H2O | 1 б |
| «... этот еще не открытый элемент должен был стать своеобразным «замком», связывающим два типичных неметалла – углерод и кремний с двумя типичными металлами – олово и свинец». Д.И.Менделеев | 1 б | |
| Всего | 12 б |
Задача 8-2. «Чист ли воздух?»
Воздух, загрязненный сероводородом, в течение пяти часов пропускали со скоростью 10 л/с через концентрированный раствор гидроксида натрия, а потом добавили к этому раствору йодную воду до ее обесцвечивания. Выпавший желтый осадок взвесили и установили, что его масса составляет 0,32г.
1) Напишите уравнения реакций сероводорода с гидроксидом натрия, полученного раствора с настойкой иода.
2) Рассчитайте количество и массу сероводорода, учитывая массу выпавшего желтого осадка.
3) Соответствует ли анализируемый воздух санитарным нормам, если предельно допустимая среднесуточная концентрация (ПДКСС) сероводорода в воздухе на уровне 0,008 мг/м3?
4) Какой вывод можно сделать по полученным данным?
Решение:
| Содержание верного ответа и указания по оцениванию(допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
| 1) Составим уравнения реакции: Н2S + 2NaOH = Na2S + 2H2O Na2S + J2 = S↓ + 2NaJ | 1б 1б |
| 2) Найдем количество вещества серы: n(S) =0,32г: 32г/моль = 0,01моль | 1б |
| n(S) = n(Na2S) = n(H2S) = 0,01моль; m(Н2S) = 0,01г х 34г/моль = 0,34г. | 1б 1б |
| 3) Найдем объем воздуха, пропущенного через раствор NaOH: V(воздуха) = 10л/с х 3600 с/ч х 5ч = 180м3. Для сравнения полученных данных со значением ПДКСС необходимо перевести их в одинаковую размерность: m(H2S): V(воздуха) =0,34 х 1000(мг): 180(м3) = 1,89мг/м3; ⇒нет; | 2б 2б |
| 4) Вывод: 1,89мг/м3 > 0,008мг/м3, что значительно выше санитарной нормы, анализируемый воздух является опасным для окружающих. | 1б |
| Максимальный балл |
Задача 8-3. Напишите формулы соединений, названия которых приведены ниже. Все они состоят из двух элементов, один из которых – водород. Если затрудняетесь, напишите хотя бы символ второго элемента, входящего в состав каждого из них.
1) Бромистый водород
2) Сероводород
3) Герман
4) Фосфин
5) Гидрид кальция
6) Силан
7) Арсин
8) Станнан
9) Метан
10) Диборан
Решение:
1)HBr; 2) H2S; 3) GeH4; 4) PH3; 5) CaH2; 6) SiH4; 7) AsH3; 8) SnH4; 9) CH4; 10) B2H6
Date: 2016-11-17; view: 362; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |