
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Составление таблицы термодинамических данных.
Содержание.
1. Формулировка задачи…………………………………………………….……..3
2. Составление таблицы термодинамических данных……………………….….3
3. Расчет изменения теплоемкости  (
( )……………………………………..4
)……………………………………..4
4. Расчет изменения энтальпии  (
( )…………………………………………5
)…………………………………………5
5. Расчет изменения энтропии  …………………………………………..7
…………………………………………..7
6. Расчет изменения энергии Гиббса 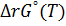 …………………………………...9
…………………………………...9
7. Расчет константы равновесия…………………………………………………10
8. Расчет равновесия константы газовой фазы………………………………….11
Список литературы
Расчет химического равновесия по табличным термодинамическим данным.
Формулировка задачи.
Рассчитать изменение функций 
 (
( );
); 
 (
( );
); 
 (
( );
); 
 (
( ) и
) и  (
( ) для формулы:
) для формулы:
III  +
+ 

 +
+ 
в интервале температур 400-800 К по термодинамическим данным табл.№1
Построить графики этих функций с температурным шагом 50 градусов. Проанализировать изменения функций при росте температуры. Общее давление равно 1атм. Сделать заключение.
Составление таблицы термодинамических данных.
Таблица №1. Термодинамические данные веществ реакции III
| В-во | Фаза |  (298, i), кДж/моль (298, i), кДж/моль
|  (298, i), Дж/ моль (298, i), Дж/ моль 
|  ф-п
K ф-п
K
|  Ф-п Ф-п  (i)
кДж/моль (i)
кДж/моль
| Коэффициент ур-я  Дж/моль
Дж/моль  K K
| |||
| а | в | с | д | ||||||
| PbS | тв | -94,2 | 91,27 | 36,43 | 44,631 | 16,412 | - | - | |
| H2 | г | 130,6 | - | - | 27,72 | 3,39 | - | - | |
| Pb | тв | 64,354 | 600,6 | 4,777 | 23,61 | 9,63 | - | - | |
| Pb | ж | - | - | 177,9 | 32,45 | -3,056 | - | - | |
| H2S | г | -20,1 | 205,57 | - | - | 29,391 | 15,407 | - | - |
Табличные данные показывают, что в интервале температур 400-800 K происходит переход свинца из твердого состояния в жидкое при температуре 600 K. Следовательно, расчету подлежат две химические реакции:
IV  400-600 K
400-600 K
V  600-800 K
600-800 K
3. Расчет изменения теплоемкости  (
(  ).
).
Изменение теплоемкости  (
( ) реакций (IV) и (V) определяются уравнениями (5) и (6) [1*, c.6].
) реакций (IV) и (V) определяются уравнениями (5) и (6) [1*, c.6].
Подставляем в них температурные данные

для реакции (IV):

(1) 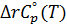 = -19,35+5,235
= -19,35+5,235  , Дж/К;
, Дж/К;
для реакции (V):

(2)  = – 10,51 – 7,451
= – 10,51 – 7,451  (
( ), Дж/К.
), Дж/К.
Сравнивая уравнения (1) и (2) видим, что переход вещества из твердого состояния в жидкое приводит к изменению термодинамической характеристики реакции. Расчет по формулам (1) и (2) представим в таблице №2 и графиком (рис.1).
Таблица №2. Расчетные значения  и
и  реакции (III)
реакции (III)
 , К , К
| -19,35 | 5,235  T T
|  , Дж/К , Дж/К
|
| -19,35 | 2,094 | -17,256 | |
| -19,35 | 2,356 | -16,994 | |
| -19,35 | 2,618 | -16,733 | |
| -19,35 | 2,879 | -16,471 | |
| -19,35 | 3,141 | -16,209 |
 , К , К
| -10,51 | -7,451  T T
|  , Дж/К , Дж/К
|
| -10,51 | -4,471 | -14,981 | |
| -10,51 | -4,843 | -15,353 | |
| -10,51 | -5,216 | -15,726 | |
| -10,51 | -5,588 | -16,098 | |
| -10,51 | -5,961 | -16,471 |
Рисунок 1.Зависимость изменения теплоемкости реакции (III) от температуры

4. Расчет изменения энтальпии  (
(  ).
).
Изменение энтальпии описывается уравнением (7) [1, c.6]. Представляем общее уравнение двумя частями для реакций (IV) и (V):

для интервала 400-600 К.
По уравнению (9) определяем  [1, c.6]:
[1, c.6]:
(3) 
 = – 20,1 – (– 94,2) = 74,1 кДж
= – 20,1 – (– 94,2) = 74,1 кДж
 = 74100 +
= 74100 +  = 74100 – 19,35(
= 74100 – 19,35( -298) + 5,235
-298) + 5,235  (
( ) = 79401 – 19,35
) = 79401 – 19,35  + 5,235
+ 5,235 
Для интервала 600-800 К:

 = 70932 + 4777
= 70932 + 4777  = 70932 + 4777 – 10,51 (T – 600) – 7,451
= 70932 + 4777 – 10,51 (T – 600) – 7,451  (
( = 84698 – 10,51 T – 7,451
= 84698 – 10,51 T – 7,451 
Представим расчет таблицей (таблица №3) и графиком (рис.2)
Таблица №3. Расчетные значения  реакции (III)
реакции (III)
| Т, К | -19,35 Т | 5,235 
|  , Дж , Дж
| |
| -7740 | ||||
| -8708 | ||||
| -9675 | ||||
| -10643 | ||||
| -11610 |
| Т, К | -10,51 Т | -7,451 
|  , Дж , Дж
| |
| -6306 | -4471 | |||
| -6832 | -4843 | |||
| -7357 | -5216 | |||
| -7883 | -5588 | |||
| -8408 | -5961 |
Рисунок 2. Зависимость изменения энтальпии реакции (III) от температуры

Из рисунка 1 видно, что с ростом температуры  не меняет свой знак на всем протяжении, поэтому
не меняет свой знак на всем протяжении, поэтому  убывает. В точке разрыва (Т = 600К)
убывает. В точке разрыва (Т = 600К)  меняется скачком.
меняется скачком.
5. Расчет изменения энтропии 
Изменение энтропии реакции описывается уравнением (8) [1; c.6]. Представляем общее уравнение двумя частями для реакции (IV) и (V).

Для интервала 400-600 К
по уравнению (10) [1, c.7] определим 

 = 64,354 + 205,57 – 91,27 – 130,6 = 48,054 Дж/К
= 64,354 + 205,57 – 91,27 – 130,6 = 48,054 Дж/К
 = 48,054 +
= 48,054 +  = 48,054 – 19,35(ln T – ln298) + 5,235
= 48,054 – 19,35(ln T – ln298) + 5,235  (T – 298) = 156,733 – 19,35ln T + 5,235
(T – 298) = 156,733 – 19,35ln T + 5,235  T
T
Для интервала 600-800 К

 = 36,093 + 7,962 +
= 36,093 + 7,962 + 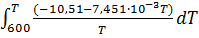 = 36,093 + 7,962 – 10,51(ln T – ln600) – 7,451
= 36,093 + 7,962 – 10,51(ln T – ln600) – 7,451  (T – 600) = 115,757 – 10,51ln T – 7,451
(T – 600) = 115,757 – 10,51ln T – 7,451 
Расчеты представим таблицей №4 и графиком (рис.3)
Таблица №4. Расчетные значения  реакции (III)
реакции (III)
 К К
| 156,733 | -19,35ln T | 5,235  T T
|  , Дж/К , Дж/К
|
| 156,733 | -115,935 | 2,094 | 42,892 | |
| 156,733 | -118,214 | 2,356 | 40,875 | |
| 156,733 | -120,253 | 2,618 | 39,098 | |
| 156,733 | -122,097 | 2,879 | 37,515 | |
| 156,733 | -123,781 | 3,141 | 36,093 |
 К К
| 115,757 | -10,51 ln T | -7,451 
|  , Дж/К , Дж/К
|
| 115,757 | -67,232 | -4,471 | 44,055 | |
| 115,757 | -68,073 | -4,843 | 42,841 | |
| 115,757 | -68,852 | -5,216 | 41,690 | |
| 115,757 | -69,577 | -5,588 | 40,592 | |
| 115,757 | -70,255 | -5,961 | 39,541 |
Рисунок 3. Зависимость изменения энтропии реакции (III) от температуры
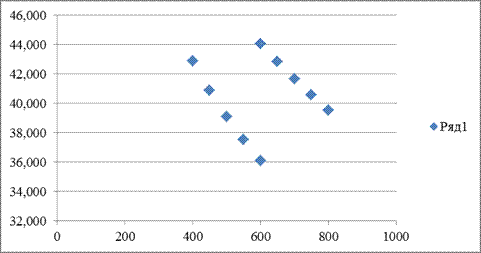
Сравним графики функций 2 и 3. Видим, что поведение обеих функций  и
и  при изменении температуры подобно.
при изменении температуры подобно.
6. Расчет изменения энергии Гиббса 
Изменение энергии Гиббса реакции (III) описывается уравнением (3) [1, c.5]

Расчеты представим в виде таблицы №5 и графиком (рис.4)
Таблица №5. Расчетные значения  реакции (III)
реакции (III)
| T, К | 
| 
| 
|  , Дж , Дж
|
| 42,892 | ||||
| 40,875 | ||||
| 39,098 | ||||
| 37,515 | ||||
| 36,093 | ||||
| 44,055 | ||||
| 42,841 | ||||
| 41,690 | ||||
| 40,592 | ||||
| 39,541 |
Рисунок 4. Зависимость изменения энергии Гиббса реакции (III) от температуры

Date: 2016-11-17; view: 516; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |