
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Опосредованные эффекты облучения и их роль в исходе поражения организма
|
|
Независимо от конкретных механизмов первичная реакция, развивающаяся при общем облучении или при массированном облучении определенных сегментов тела, также не может быть объяснена повреждением критических систем и требует признания ее опосредованного или дистанционного характера.
Не поддаются объяснению и локальные тканевые реакции, например ранняя преходящая эритема кожи, развивающаяся совершенно независимо от повреждения эндотелия сосудов и тем более от повреждения клеток кожи, так как она появляется задолго до этих изменений.
Все это свидетельствует о том, что в облученном организме серьезные повреждения одних тканей и систем неизбежно вызывают реактивные или взаимосвязанные изменения в других, относительное значение которых в патогенезе и исходе поражения нуждается каждый раз в оценке, учитывающей его конкретные особенности.
Наличие опосредованных радиационных влияний требует учета их определенного участия в любых лучевых реакциях, включая реакции клеточных популяций, подвергающихся локальному облучению в организме и находящихся под контролем его регулирующих систем и гуморальных факторов. Отсюда возникает задача расчленения непосредственного и опосредованного компонента в реакциях организма на облучение на всех уровнях организации, решение которой усложняется по мере усложнения объекта облучения.
Далеко не просто отнести многочисленные функциональные, биохимические и даже структурные нарушения органов и тканей к той или иной категории непосредственных или опосредованных реакций в организме. Во многих случаях эти вопросы пока еще являются предметом дискуссии и дальнейшего изучения. Останавливаясь лишь на отдельных сторонах данной проблемы, прежде всего во избежание недоразумений в понимании ее сути, необходимо коротко рассмотреть вопросы терминологии.
Иногда непосредственные и опосредованные эффекты ионизирующих излучений обозначают соответственно как прямое и непрямое или первичное и вторичное действие. Использование этих терминов для обозначения непосредственных и опосредованных лучевых реакций нецелесообразно, так как в радиобиологии им придается другой, физико-химический смысл.
Кроме того, опосредованное влияние ионизирующих излучений часто называют дистанционным, поскольку во многих случаях вызываемые ими эффекты проявляются вне облученных тканей.
(В иностранной литературе этому термину соответствует выражение abscopal effect (от лат. ab — приставка, обозначающая удаление; scopos – цель, мишень.)
Однако, по мнению А. Г. Свердлова, много лет занимающегося данной проблемой, эти понятия нельзя считать синонимами. Их значения могут совпадать, если рассматривать изменения вне облученного поля, ибо в этом случае опосредованное влияние одновременно является и дистанционным. Повреждение же облученных клеток и тканей может быть не только непосредственным, но и опосредованным, совсем не будучи дистанционным или, являясь интегральной реакцией, включает дистанционное влияние в качестве одного из компонентов.
«Иными словами, дистанционное действие всегда опосредованное, но опосредованное не всегда дистанционное. Термин «опосредованное» действие радиации более выражает сущность описываемого явления и поэтому заслуживает предпочтения» (А. Г. Свердлов, 1968).
Одним из распространенных способов выявления опосредованных, а именно дистанционных эффектов ионизирующих излучений, является локальное облучение какого-либо сегмента тела с последующим сравнительным наблюдением за состоянием системы кроветворения в облученном и экранированном участках.
Как показали результаты экспериментов, проведенных на животных разных видов, гибель и исчезновение клеток костного мозга происходят не только в облученных, но и в экранированных зонах, однако в последних они выражены в значительно меньшей степени.

Рис. III.51. Динамика клеточного опустошения костного мозга крыс, подвергнутых субтотальному (одна конечность экранирована) рентгеновскому облучению в дозе 10 Гр (по А. Л. Выгодской, 1967):
1 - облученный костный мозг, 2 - экранированный костный мозг, 3 – костный мозг при мнимом облучении (контроль)
На рис. III.51 приведена динамика опустошения костного мозга крыс в течение первых 48 ч после облучения, изученная на 300 животных. В экранированном участке наблюдалось уменьшение общего числа клеток костного мозга уже через 1,5 – 3 час после облучения; эффект достигал максимума (~ 25 %) к шестому часу и сохранялся на этом уровне до конца наблюдения.
Не исключено,— что в первые 3 ч значительная часть эффекта является результатом стресса, вызванного самой процедурой облучения, о чем свидетельствуют результаты специальных опытов, проведенных на 190 крысах, подвергнутых мнимому облучению с выполнением всех связанных с ним процедур (рис. III.51, кривая 3). Однако если влияние процедурного стресса и проявляется, то лишь в первые часы после воздействия: в поздние же сроки им можно пренебречь, ибо эффект мнимого облучения снижается к шестому часу, а через 24 ч число клеток костного мозга возвращается к норме.
При анализе изменений числа клеток разных ростков в экранированном участке костного мозга установлено, что причинами его опустошения являются: перераспределение отдельных форменных элементов, подавление процессов клеточного деления при продолжающемся выходе зрелых клеток на периферию и гибель наиболее радиочувствительных элементов (эритробластов, миелобластов и лимфоцитов).
Существуют и другие данные, свидетельствующие о дистанционном влиянии облучения на кроветворение: например, об увеличении числа клеток с хромосомными аберрациями в экранированном костном мозге мышей (Н.Ф. Баракина, М. Н. Янушевская, 1966), а также в костном мозге крыс после введения им экстракта из тканей облученных животных (Ю. М. Керкис и др., 1964). В экранированном костном мозге крыс наблюдали повышение ультрафиолетовой флуоресценции (С.Н. Александров, 1966). Весьма показательны эксперименты по обнаружению усиления нарушений в костном мозге и селезенке по различным биохимическим и морфологическим показателям при тотальном облучении по сравнению с локальным.
В настоящее время практически отсутствуют данные, свидетельствующие об опосредованном влиянии облучения на периферическую кровь. Имеющиеся суждения на этот счет основаны на неправильной интерпретации лимфопении, наблюдаемой при локальном облучении, которой без достаточных оснований приписывали дистанционную природу. На самом деле причина лимфопении в этих случаях определяется интерфазной гибелью лимфоцитов, проходящих с током крови в сосудах облучаемой зоны.
Приведенные данные о дистанционном действии ионизирующих излучений на кроветворение дают основание считать, что оно вносит какую-то долю в изменения, наблюдаемые и в облученных участках кроветворных тканей, а также при тотальном облучении. Об этом же свидетельствует усиление выраженности дистанционного влияния с увеличением объема облучаемых тканей. Следовательно, такие изменения правильнее назвать опосредованными, тем более что в их формировании принимают участие регулирующие системы организма, в первую очередь центральная нервная и эндокринная системы. Особенно это характерно для участия этих систем в формировании функциональной неполноценности кроветворения в отдаленные сроки после облучения.
Оценивая роль опосредованного компонента в общем эффекте лучевого поражения кроветворения, следует отвести ему лишь второстепенное значение. Об этом свидетельствуют результаты экспериментов, показавшие резкое повышение выживаемости облученных животных при экранировании незначительных участков костного мозга или даже при ослаблении их поражения созданием аноксии, например наложением лигатуры на конечности. Следовательно, ведущую роль в лучевом, поражении кроветворения играют процессы, непосредственно протекающие в молекулах и микроструктурах облучаемых клеток.
К числу нарушений в некритических системах относятся различные проявления изменений со стороны ЦНС и органов чувств, эндокринной, иммунной, сердечно-сосудистой и пищеварительной (исключая тонкий кишечник) систем, органов выделения, системы дыхания, печени, костно-мышечной системы, органов размножения и других клеточных систем, условно называемых некритическими, так как они не ответственны за непосредственный исход лучевого поражения организма. Это не исключает, однако, их роли в процессах восстановления, а также в отдаленных последствиях облучения. Более того, во многих случаях такого рода нарушения приобретают решающее значение, в связи с чем, как было показано на многочисленных примерах, понятие радиоустойчивости в отношении этих систем следует понимать как достаточно условное.
Не случайно в последние годы резко повысилось внимание многих исследователей к нарушениям, возникающим в различных стабильных (в цитокинетическом отношении) высокодифференцированных тканях. Это и понятно, ибо теперь, когда большое число вопросов патогенеза острого лучевого синдрома изучено достаточно подробно, выявились «белые пятна» в результате своеобразных «находок» как в эксперименте, так и в клинике, свидетельствующих о весьма существенных для организма нарушениях, «неожиданно» возникающих в той или другой «нерадиочувствительной» системе.
Такие «находки» в виде функциональных нарушений обнаружены практически во всех органах и системах животных и человека (речь не идет о стойких органических поражениях, обнаруживаемых в поздние сроки: нефросклерозе, пневмосклерозе и др.). Поэтому здесь будут приведены лишь примеры нарушений в сердечно-сосудистой системе (к которой привлечено особое внимание в связи с развитием радиоангиокардиологии).
В нескольких докладах на V Международном конгрессе по радиациоционным исследованиям было обращено внимание на возникновение ранних изменений в сердце и сосудах. В одном из докладов было показано, что при γ-облучении перфузируемых препаратов сердца кроликов сокращаемость миокарда подавлялась, начиная с дозы 9 Гр. а кровоток в коронарных сосудах уменьшался уже при дозе 3 Гр; по достижении дозы 17 Гр изучаемые показатели снижались на 48 и 61 % соответственно.
В другом докладе были показаны два типа механических реакций на облучение, возникающих в сосудах. 1. Немедленный ответ (латентное время - несколько секунд) — тонические мышечные сокращения, обратимые через несколько минут (в аорте крыс и лягушек) и полуобратимые (в аорте кролика) при дозах 2,5—10 Гр, а при дозах 10—30 Гр — немедленная обратимая релаксация почечной артерии крыс и кроликов. 2. Поздние (латентное время — несколько мин) и очень медленные (максимум после 1 ч и более) тонические сокращения с большой продолжителъностью (> 3 ч) аорты и легочной артерии морских свинок, голубей и цыплят после облучения в дозе ~ 30 Гр,
Было также сообщено о развитии отечности мышечной стенки аорты у кроликов (после облучения в дозах 8 и 10 Гр; регистрация с помощью световой микроскопии), предшествовавшей другим видимым изменениям; затем в основном веществе появлялись дискретные кальциевые гранулы, число и размеры которых со временем увеличивались. Электронно-микроскопически обнаруживались изменения в vasa vasorum, дегенерация мышечных клеток, кальцификация миофибрилл.
Чрезвычайно показательны данные клинических наблюдений за больными лимфогранулематозом (81 человек), подвергавшимися ежедневному γ-облучению 60Со в области грудной клетки (средняя доза на область сердца за 22—35 сеансов ~ 45 Гр).
В 92% случаев через 12 мес после окончания лечения появились симптомы выпотного перикардита, причем у 24 больных выпот в перикарде был обнаружен рентгенологически. 11 больным была проведена катетеризация отделов правой половины сердца для подтверждения наличия выпота. У 14 больных выпот был преходящим, пяти больным из 11 произведено рассечение перикарда из-за тампонады сердца. Механизмы появления пострадиационного перикардита остались невыясненными.
Внимание к изменениям сердечно-сосудистой системы, как и других высокодифференцированных органов и систем, особенно ЦНС и эндокринной системы, впервые было привлечено советскими исследователями. Это самые ранние работы И. Ф. Тарханова и последующие широко известные экспериментальные исследования Л. А. Орбели, А. В. Лебединского, П. Д. Горизонтова, М. Н. Ливанова, Н. Н. Лифшиц, Ю. Г. Григорьева, Е. И. Воробьева, С. Н. Александрова, а также клинические наблюдения М. И. Неменова, М. П. Домшлака, А. К. Гуськовой и другие работы, посвященные проблеме нарушения в регулирующих системах и соматическим эффектам облучения.
Изменениям, которые происходят в иммунной системе, занимающей промежуточное место между критическими и некритическими системами организма, принадлежит особая роль в патогенезе лучевой болезни. Частично они рассматривались, например, при анализе причин инфекционных осложнений, а такие, как временная толерантность (вследствие массовой гибели лимфоцитов, являющихся иммунокомпетентными клетками), будут рассмотрены при описании основ трансплантационной терапии лучевого синдрома.
Наиболее демонстративным проявлением радиационного повреждения иммунитета признаны иммунодефицит и повышение чувствительности к возбудителям инфекционных заболеваний, сопровождающиеся количественными и качественными изменениями нормальной микрофлоры организма, в частности кишечника.
Причинами иммунодепрессии и иммунодефицита, развивающихся вскоре после облучения, являются гибель, повреждение функции и миграционных свойств лимфоцитов, а также нарушение количественного соотношения субпопуляций лимфоцитов и их функциональных взаимодействий. Как показали результаты работ А. А. Ярилина (1981), изучавшего клеточные механизмы действия радиации на иммунитет, нарушение нормальных количественных соотношений субпопуляций лимфоцитов обусловлено их различной радиочувствительностью: В-клетки более радиочувствительны, чем Т-клетки; Т2-лимфоциты и кортизончувствительные формы поражаются ионизирующей радиацией сильнее, чем, соответственно, Т1-лимфоциты и кортизонустойчивые. Однако численность В-клеток восстанавливается быстрее, чем численность Т-клеток. В результате создающийся сразу после облучения относительный избыток Т-клеток сменяется периодом, когда иммунный ответ лимитирует их численность. Это определяет различную эффективность введения Т- и В-клеток в разные сроки после облучения.
Основное проявление индуцируемого облучения миграционного дефекта лимфоцитов, разумеется, кроме резкого уменьшения их численности, состоит в нарушении способности выживших циркулирующих клеток проникать в лимфатические узлы. Нарушение миграции Т-лимфоцитов в лимфатические узлы — очень устойчивый радиационный эффект, вследствие которого замедляется темп восстановления численности Т-клеток и уровня тимусзависимого ответа, что составляет причину позднего иммунодефицита.
Нормализация функции лейкоцитов осуществляется параллельно с восстановлением их численности и связана, вероятно, с замещением клеток, переживших облучение, вновь образованными. Параллельно с восстановлением функции Т- и В-клеток нормализуется их способность к кооперации.
Значительно менее выражены клеточные нарушения иммунитета при местном облучении, в частности при лучевой терапии. В этом случае активно циркулирующие Т-клетки поражаются в большей степени, чем слабо рециркулирующие В-клетки, что легко объяснить, ибо наблюдающаяся лимфопения при локальных облучениях является следствием интерфазной гибели лимфоцитов, проходящих через зону облучения.
Таковы основные причины и механизмы клеточных аспектов иммунологической депрессии, возникающей после облучения.
Нарушение антимикробного иммунитета и связанные с ним инфекционные осложнения, кроме того, можно рассматривать как следствие повышения проницаемости тканевых барьеров, нарушения фагоцитарной способности клеток ретикулоэндотелиальной системы и угнетения неспецифических бактерицидных систем организма — пропердина, лизоцима, бактерицидных субстанций ряда тканей, а также бактерицидности кожи. Кроме того, облучение угнетает образование новых антител, хотя почти не влияет на их продукцию, если проведено после иммунизации.
Большое значение имеют также развивающиеся в облученном организме аутоиммунные процессы, составляющие самостоятельную проблему неинфекционной иммунологии.
Аутоантигенами в принципе могут быть как нормальные ткани при их попадании в русло крови, где они обычно не встречаются, так и патологически измененные белки и связанные с ними вещества. После облучения создается реальная возможность столкновения организма с аутоантигенамн обоих видов вследствие быстро развивающейся тканевой деструкции, резкого повышения проницаемости биологических барьеров и изменения антигенных свойств тканей.
На рис. III.52 представлена схема, иллюстрирующая возможные патологические сдвиги в облученном организме, связанные с изменением и циркуляцией тканевых антигенов. После облучения происходит утрата части нормальных антигенов и появление новых антигенных качеств. Кроме того, летальные повреждения клеток могут обусловить появление новых антигенных свойств белков вследствие постлетальных изменений. Потеря части нормальных антигенов, означающая утрату определенных структур, может быть причиной нарушения определенных функций клеток и органов. Это, а также клеточная деструкция и циркуляция в крови тканевых антигенов способствуют развитию токсемии. Кроме того, циркуляция в крови тканевых антигенов приводит к иммунологической перестройке организма — сенсибилизации и образованию антител двух родов — против денатурированных белков и против аутотканей. Уже в момент появления антигенной чужеродности измененные белки могут быть причиной патологической афферентной импульсации, которая в дальнейшем, воздействуя на хеморецепторы, обеспечивает патологическое влияние через нервную систему.
Таким образом, в настоящее время твердо установлены факты, характеризующие все этапы аутоиммунологических изменений в облученном организме: образование аутоантигенов, их циркуляцию, появление аутоантител и аутосенсибилизацию.
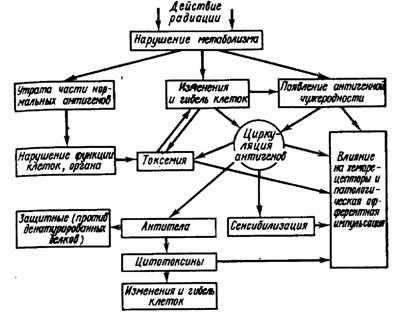
Рис. III.52. Последовательность процессов, связанных с изменением антигенных свойств тканей и циркуляцией тканевых антигенов после облучения (по Р. В. Петрову, 1962)
Н. Н. Клемпарская, наиболее известный исследователь в этой области, отводит аутоаллергии ведущую роль в развитии лучевой болезни, которую она рассматривает как своеобразное аутоиммунное заболевание, характеризующееся выраженной направленностью реакций против распада собственных тканей в сторону сенсибилизации, что придает болезни особенно тяжелый характер и может, в частности, быть причиной развития некротических процессов и геморрагии. В подтверждение этой точки зрения приводится обширный экспериментальный материал, в том числе данные о профилактической и терапевтической эффективности при лучевой болезни вакцинации и различных десенсибилизирующих средств.
Признавая несомненную роль аутоиммунных процессов в патогенезе непосредственных и отдаленных последствий облучения организма, нельзя забывать о первопричинах острого лучевого синдрома, обусловленных клеточными утратами в критических системах клеточного обновления.
Радиационные изменения, происходящие под влиянием облучения по существу во всех тканях, не могут не сказаться на обмене веществ. Как и другие разделы радиобиологии, и, пожалуй, в большей степени, радиационная биохимия (а именно она занимается этими вопросами) является самостоятельной областью знаний, здесь лишь будут намечены основные аспекты этой проблемы.
Обсуждая биохимические процессы в подвергнутом облучению организме, следует всегда иметь в виду их деление на две категории: биохимический этап в механизме первичного действия ионизирующих излучений и биохимические изменения, происходящие в организме при развитии лучевой болезни и ее отдаленных последствий.
О биохимическом этапе первичного действия ионизирующих излучений частично речь шла выше. Необходимо добавить, что следствием этих процессов, очевидно, следует признать такие важные цитологические события, как мутации, в частности разрывы хромосом, а также повреждения, приводящие к интерфазной гибели клеток.
О том, что разрыв хромосомы — значительно более сложное событие, чем механическое следствие прохождения ионизирующей частицы (нескольких частиц), свидетельствует хотя бы существование химического мутагенеза, биохимическая природа которого едва ли подлежит сомнению.
Свидетельством механического компонента хромосомного разрыва можно считать зависимость выхода хромосомных аберраций от ЛПЭ, хотя разрыв не обязательно происходит в месте прохождения частицы. Эти противоречия частично устраняются принятием гипотезы высвобождения ферментов вследствие радиационного нарушения внутриклеточных структур с последующей активацией ферментов и нарушением их пространственной координации.
Повреждение ядерных и других внутриклеточных мембран облегчает возможность ферментативной атаки ДНК. О важности и реальности феномена раннего повреждения мембран свидетельствуют оригинальные эксперименты Р. Бринкмана, показавшие, что нарушение проницаемости синовиальной оболочки и тонких слоев эпидермиса происходят при дозе 2 Гр уже в течение первой секунды после воздействия.
Однако этих примеров явно недостаточно для принятия какой-либо гипотезы, точно соответствующей последовательности биохимических процессов, вызывающих важнейшие для судьбы клетки события на молекулярном уровне.
Начиная с работ 40-х годов, и по сей день, известны данные о высокой радиочувствительности процесса биосинтеза ДНК. Существуют данные о нарушении самых ранних этапов синтеза предшественников ДНК — мононуклеотидов, фосфорилирования тимидинмонофосфата до тимидинтрифосфата, а также конечных этапов синтеза — полимеризации трифосфатов дезоксинуклеотидов на матрице.
Биосинтез РНК более резистентен, чем биосинтез макромолекул ДНК. По-видимому, радиационное угнетение биосинтеза РНК определяется не недостатком предшественников или снижением активности РНК-полимеразы, а опять же повреждением ДНК-матрицы вплоть до того, что она сама вызывает ингибирование активности этого фермента. Наиболее радиорезистентен процесс синтеза белка. Причем экспериментальный материал в этом направлении получен в основном при работе с мечеными аминокислотами, включение которых в суммарные тканевые белки изучали спустя длительное время.
Одной из самых лабильных и рано ингибируемых биохимических систем является окислительное фосфорилирование, особенно в клетках радиочувствительных органов. Его разобщение в митохондриях селезенки отмечается в ближайший пострадиационный период при дозе 1 Гр. В ядрах клеток костного мозга, слизистой кишечника и лимфатических узлах крыс через 1 ч после облучения фосфорилирование ингибируется или даже прекращается при дозах 0,25—0,5 Гр, а при дозе 1 Гр восстановление этого процесса происходит только через 5 сут. В радиорезистентных органах обратимое разобщение окислительного фосфорилирования наступает только при минимально летальных дозах.
Приведенных данных, однако, вовсе недостаточно, чтобы приписать и этому биохимическому процессу ведущую роль в определении радиочувствительности, если учесть, что применение типичных разобщителей окислительного фосфорилирования, например динитрофенола, не оказывает радиосенсибилизирующего действия, а протекторы, например аминотиолы, угнетают этот процесс.
Перечисленные ранние нарушения основных биохимических процессов могут усиливаться в результате развития в ядре и цитоплазме вторичных процессов в ранние сроки после облучения. Например, накопление некоторых метаболитов ДНК при активации процессов катаболизма может привести к угнетению отдельных ферментативных реакций ее синтеза. Изменение проницаемости мембран, происходящее после облучения, может повлечь за собой обеднение ядра ионами металлов или некоторыми важными метаболитами. Этот же процесс может привести к выходу в цитоплазму самых разнообразных, в том числе катаболических, ферментов.
Таким образом, регуляция обменных процессов после облучения нарушается не только на молекулярном, но и на структурном уровне. Развиваясь, суммируясь и взаимно влияя друг на друга, эти процессы вызывают в разных тканях различные поражения. Это в свою очередь обусловливает возникновение межтканевых и межсистемных нарушений в организме, выражением которых и являются разнообразные нарушения обмена веществ, наиболее общие, типичные из которых особенно ярко проявляются в периоды разгара лучевой болезни и непосредственного восстановления.
Значительные нарушения белкового обмена определяются, прежде всего, процессами массовой клеточной деструкции радиочувствительных систем, сопровождающейся уже на ранних этапах повышенным содержанием азотсодержащих веществ в крови, а также выделением таурина (рис. III.53) и других аминокислот с мочой. Эти показатели наряду с анализом метаболитов нуклеинового обмена (например, дезоксицитидина) используют как раннюю диагностическую реакцию. О нарушении обмена белков свидетельствуют описанные выше угнетение выработки антител и других специфических иммунных белков, нарушение их антигенной структуры и т.п. Существуют данные об активации облучением многих ферментов — протеиназ, триптофаноксидазы, карбоксипепсидазы, щелочной и кислой фосфатаз, описано резкое усиление синтеза гемина и ослабление синтеза глобина (после кратковременной активности) в ретикулоцитах. Активация протеолитических ферментов, с которой в значительной степени связывают распад тканевых белков, в свою очередь, по-видимому, является не только следствием повышения проницаемости мембран клеточных органелл, но и результатом нарушения регуляции со стороны гипофизадреналовой системы.
Значительно более устойчив обмен углеродов, синтез которых если и нарушается, то только в поздние стадии лучевого поражения как результат глубокого патологического изменения органа, в котором он осуществляется. Наблюдаемые сдвиги в содержании гликогена в крови и печени в значительной степени связаны с нарушениями регуляции со стороны надпочечников и частично с повреждением самих печеночных клеток (Б. М. Граевская, 1976). Относительно большой радиочувствительностью обладают высокополимерные полисахариды, выполняющие специальные функции во многих тканях и жидкостях организма. В частности, деполимеризация гиалуроновой кислоты, регулирующей проницаемость соединительной ткани, наступает рано и при сравнительно небольших дозах облучения (5—10 Гр). С деполимеризацией мукополисахаридов связывают резкое усиление диффузии введения в кожу различных красителей под влиянием облучения в дозах 1 Гр и выше.

Рис. III.53. Экскреция таурина (по Г. Каю, Дж. Энтерману, 1959):
1 — контрольные крысы, 2 — после облучения в дозе I Гр, 3 — после облучения в дозе 6 Гр; вертикальной пунктирной линией отмечен момент облучения
Большой интерес представляет изучение радиационных нарушений обмена липидов. Благодаря их легкой окисляемости, усиливающейся под действием облучения, образующиеся пероксиды участвуют в первичных пострадиационных процессах в форме органических радикалов. Это послужило основанием для детальных исследований роли нарушений липидного обмена в радиационной патологии (Б. Н. Тарусов, Н. М. Эмануэль, Ю. Б. Кудряшов, Е. Б. Бурлакова и др.).
Н. М. Эмануэлем, в частности, постулировались представления о значении свободнорадикальных процессов и их ингибировании природными антиоксидантамн. Развивая эту концепцию, Е. Б. Бурлакова с соавторами (1975) показала, что в органах облученных мышей антиокислительная активность резко снижается; например, в селезенке через 24 ч после облучения в среднелетальных дозах она падает до нуля. При меньших дозах и в радиорезистентных органах падение антиокислительной активности выражено в меньшей степени.
Интересна интерпретация данных о радиационных изменениях липидов с учетом роли клеточных мембран. В последние годы наряду с известными механизмами регуляции клеточного метаболизма (репрессия — депрессия гена, аллостерическая регуляция ферментативной активности и система АМФ) большое внимание уделяется изучению регуляторной роли мембран. Структура и функция мембран, являющихся кооперативными системами, тесно связаны с составом и свойствами их основных компонентов: липидов и белков. Ряд авторов придает большое значение окислительным превращениям в липидах мембран как источнику изменения их функциональной активности, саморазборки и деградации. Е. Б. Бурлаковой с сотрудниками установлено, что в норме существует определенная взаимосвязь между изменениями состава липидов и скоростью окислительных реакций. При усилении окислительных реакций липиды мембран обогащаются наиболее устойчивыми к окислению фракциями: сфингомиелином и фосфатидилхолином, а при торможении окислительных реакций — наиболее лабильными: фосфатидилсерином, фосфатидилинозитом и фосфатадилэтаноламином. Такого рода связь может рассматриваться как система, поддерживающая уровень окислительных реакций в стационарном состоянии.
При действии излучения наблюдаются уменьшение антиокислительной активности липидов, интенсификация окислительных реакций и связанное с ними изменение состава липидов мембран. В ранние сроки после облучения связь между скоростью окислительных реакций и составом липидов не отличается от нормы, однако, в последующем (например, через 3—5 сут после облучения мышей в дозах 5—6 Гр) эта взаимосвязь нарушается. Кроме того, изменение состава липидов мембран вызывает изменение ригидности мембраны, затрудняющее ее структурные перестройки и меняющее скорость ферментативных реакций, для которых эти липиды являются эффекторами. Установлено, что изменение скорости ряда ферментативных реакций после облучения может быть объяснено характером изменения относительной концентрации фосфолипидов — эффекторов для соответствующих ферментов. Изменение состава липидов мембран может изменять условия образования ДНК-мембранного комплекса, играющего важную роль в радиочувствительности и процессах восстановления после облучения. С этих молекулярно-биологических позиций находит свое объяснение связь антиокислительной активности липидов с радиочувствительностью, а также наличие корреляции между степенью изменения антиокислительной активности с помощью радиопротекторов и их защитным действием (Е. Б. Бурлакова, 1975).
Заключая раздел, нельзя не отметить, что облучение организма в летальных дозах вызывает очень незначительные изменения в общем обмене, развивающиеся в основном незадолго до гибели животного. Несмотря на структурные повреждения кишечника, всасывание продолжается без особых нарушений, а наблюдающиеся изменения во многом объясняются диспептическими расстройствами и потерей электролитов. Важно, однако, что наиболее твердо установленные факты, например серьезные нарушения нуклеинового обмена и антиокислительной активности, выражены более отчетливо в критических тканях.
В этой связи интересны обобщения, сделанные И. Н. Кендышем (1974) на основании анализа мировой литературы о биохимических механизмах радиобиологического эффекта на уровне организма. Автор справедливо критикует существующую в современной радиобиологии тенденцию рассматривать происхождение биохимических изменений с точки зрения универсальности действия радиации на процессы обмена веществ в различных системах организма и у разных объектов. И. Н. Кендыш рассматривает три категории изменений обменных процессов в облученном организме, происходящих в радиочувствительных и радиорезистентных тканях.
В радиорезистентных тканях (мышцы, головной мозг и др.) метаболические сдвиги невелики или отсутствуют, а в радиочувствительных тканях, клетки которых претерпевают интерфазную гибель уже через несколько минут после облучения, происходят существенные биохимические изменения, выражающиеся в ингибировании синтеза ДНК и активации аэробного гликолиза. Позднее нарушаются и другие метаболические процессы, которые являются следствием более грубых деструктивных изменений клеточной организации, сопутствующих предсмертному состоянию клеток; для этого периода характерны угнетение всех биосинтетических процессов и резкое усиление катаболизма с выделением различных клеточных компонентов.
В отличие от этого в печени облученных животных преобладает анаболический тип обменных сдвигов, выражающийся в усилении синтеза углеводов, липидов, белков и РНК. Анализируя результаты собственных исследований, автор считает, что активация биосинтеза основных метаболических субстратов в печени есть следствие регуляторных эффектов, вызываемых метаболитами радиочувствительных тканей, прежде всего аминокислотами.
Обобщая большой экспериментальный материал и литературные данные, И.Н. Кендыш (1974) приходит к заключению о том, что «... продукты распада радиочувствительных тканей, вступая во взаимодействие с различными структурами организма и, прежде всего с печенью, определяют ряд биохимических процессов, связанных единым происхождением или последовательностью метаболических реакций».
Согласно развиваемой концепции «между изменениями различных видов обмена в печени облученных животных существует взаимообусловленность, последовательность которой можно представить следующим образом. Аминокислоты, освободившиеся в радиочувствительных тканях вследствие их деструкции, подвергаются в печени дезаминированию и переаминированию и превращаются путем глюконеогенеза в глюкозу и гликоген. Избыточное количество новообразованной глюкозы поступает в кровь и с помощью инсулина вторично мобилизуется в печени и других тканях, где вовлекается в синтез гликогена путем гликонеогенеза. Эти процессы лежат в основе гипергликемии и увеличения содержания гликогена в печени после облучения. Сопряженное с активизацией глюконеогенеза торможение гликолиза приводит к угнетению синтеза липидов из глюкозы и компенсаторному усилению липогенеза из ацетата и жирных кислот с последующим выделением синтезированных липидов в плазму крови. Временная интенсификация синтеза липидов в жировой ткани из глюкозы обусловлена усилением глюконеогенеза в печени и ассимиляцией избытка периферической глюкозы. По такому же механизму, очевидно, усиливается липогенез в жировой ткани из ацетата и жирных кислот, которые в повышенном количестве образуются в печени, а затем утилизируются в жировой ткани. Накапливаясь в печени, свободные аминокислоты индуцируют синтез белков плазмы крови и, возможно, синтез ключевых ферментов глюконеогенеза — аминотрансфераз н некоторых других ферментов, контролирующих обмен аминокислот в печени. Развитие отрицательного азотистого баланса после облучения является следствием усиленной экскреции аминокислот, продуктов распада нуклеиновых кислот и других азотистых веществ, большое количество которых освобождается в радиочувствительных тканях, но не ассимилируется организмом».
Разумеется, приведенная концепция нуждается в экспериментальной проверке. Привлекательность изложенных положений в том, что в их рамки «... укладывается весь основной комплекс пострадиационных изменений углеводов, липидов, белков и нуклеиновых кислот. С этой точки зрения становится объяснимой фазность этих процессов, отражающая кинетику деструкции радиочувствительных тканей, трансформацию продуктов их распада в активные метаболиты и переход их в общую циркуляцию. Таким образом, распад радиочувствительных тканей можно рассматривать в качестве первичного звена патогенетической цепи нарушений промежуточного обмена веществ при острой лучевой болезни». Тем самым сложную и запутанную картину нарушений биохимических процессов удается свести в стройную единую систему, отведя каждому из них свое место на разных этапах лучевого поражения.
Весьма вероятно, что остальные, в большинстве своем маловыраженные биохимические нарушения играют определенную роль в механизме опосредованного и дистанционного действия облучения, составляя основу его токсического компонента.
Понятие токсины или радиотоксины впервые было предложено П. Д. Горизонтовым (1958) для обозначения не каких-то определенных веществ, а самых различных не идентифицированных гуморальных агентов, возникающих в тканях под действием облучения. Будучи экстрагированы из тканей или оттекающих от облученных участков крови и лимфы, такие агенты при введении интактным животным вызывали у них разнообразные опосредованные и дистанционные проявления лучевых реакций. Радиотоксинами могут быть как аномальные метаболиты, так и вещества, свойственные нормальному состоянию, но образующиеся в облученном организме в избыточном количестве, например гормоны, продукты обмена веществ и распада тканей, медиаторы и др. Речь не идет, таким образом, о каких-то специфических идентифицированных отдельных соединениях или о «первичных радиотоксинах», которым в рамках структурно-метаболической гипотезы приписывается роль инициаторов первичных процессов лучевого поражения.
Наиболее наглядно токсическая природа дистанционных эффектов в организме представлена при местном облучении. В этом случае выраженность их зависит как от объема, так и от локализации облученного участка, определяющих, с одной стороны, уровень и «качество» образующихся токсических метаболитов, а с другой—возможность их «разведения» в необлученных зонах организма. Кроме того, возникающие токсины воздействуют и на нейроэндокринный аппарат, что служит причиной ряда опосредованных эффектов, типичным примером которых можно считать упомянутое состояние рентгеновского «похмелья».
Часто можно встретить утверждения о том, что при общем облучении токсический компонент отсутствует или не играет никакой роли. Однако если признать роль радиотоксических факторов в развитии дистанционных и опосредованных эффектов при местном облучении (а для этого есть все основания), то нельзя отрицать, что те же факторы оказывают аналогичное влияние на организм и при общем облучении. Само собой разумеется, что относительное прогностическое значение их по сравнению с непосредственным действием излучения значительно меньше, но и его нельзя не учитывать. В частности, при лечении лучевой болезни следует помнить о необходимости мер, направленных на детоксикацию облученного организма — ранних кровопусканий с введением кровезаменителей, а также применения детоксикаторов, антигистаминных средств и др.
Что понимают под дистанционными и опосредованными эффектами облучения?
Как выявляется опосредованное действие облучения на систему кроветворения, и какова его роль в общем эффекте поражения этой системы?
В чем выражается радиационное нарушение иммунитета?
К чему сводятся основные нарушения обмена веществ в организме, возникающие под влиянием облучения?
Какова возможная роль токсинов (не смешивать с «первичными токсинами») в дистанционных и опосредованных эффектах облучения?
Date: 2016-05-25; view: 1867; Нарушение авторских прав