
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Плазмиды агробактерий
|
|
В качестве векторов могут использоваться опухолеобразующие плазмиды бактерий. Виды Agrobacterium эволюционно родственны клубеньковым бактериям, относящимся к роду Rhizobium, и имеют много общих с ними черт. Однако характер взаимодействия агробактерий с растением имеет своеобразные особенности.
Взаимодействие видов Agrobacterium с растениями представляет особый интерес, так как при этом виде паразитизма один из партнеров специфически видоизменяет свойства хозяина, встраивая свои гены в его геном. Кроме того, это служит уникальным примером миграции ДНК прокариот в эукариотическую клетку. ДНК митохондрий и хлоропластов Хлоропласты и митохондрии содержат полноценную генетическую систему, то есть все компоненты, необходимые для экспрессии генетической информации: ДНК, ДНК-полимеразы, РНК-полимеразы и белоксинтезирующий аппарат (рибосомы, т-РНК, аминоацил-тРНК-синтетазы).
Транспозоны
Транспозоны - сегменты ДНК, которые контролируют собственную транспозицию (перемещение) из одного сайта ДНК в другой путем вырезания из исходного сайта и внедрения в новый сайт хромосомы или плазмиды. Впервые были открыты в 40-х годах американской ученой Барбарой Мак-Клинток у кукурузы. Эти гены, индентифицированные по их способности подавлять экспрессию других генов кукурузы, находящихся рядом с ними, не имели фиксированного положения в хромосоме. Они как бы передвигались по всему геному растения. Регуляторные элементы могли встраиваться и выщепляться, причем после их выщепления зачастую начинали функционировать ранее молчащие гены.
Оказалось, что гены, ассоциированные с регуляторными элементами, становились нестабильными и часто мутировали из-за нестабильности самих этих элементов. В течение многих лет кукуруза оставалась единственной системой, в которой обнаруживались такие подвижные генетические элементы. Сейчас - и у бактерий, дрозофил и других организмов.

Рис. 4
2. Понятие о бактериофагах
Бактериофаги - (от бактерии и греч. fagos - пожиратель) - это особые представители царства вирусов.
Особенность бактериофагов в том, что они приспособились использовать для своего размножения клетки бактерий.
Эти маленькие создания потрясающе многообразны.
Вирусы бактериий, иначе называемые бактериофагами, - крупнейшая из известных групп вирусов.
Современная классификация бактериофагов включает 13 семейств, подразделенных более чем на 140 родов, которые содержат более 5300 видов фагов.
Применение современных электронных микроскопов позволило детально изучить строение фагов. Оказалось, что многие из них устроены сложнее, чем вирусы человека, животных и растений.
1 -- головка, 2-- хвост, 3 -- нуклеиновая кислота, 4 -- капсид, 5 --"воротничок", 6 -- белковый чехол хвоста, 7-- фибрилла хвоста, 8 -- шипы, 9 -- базальная пластинка
Вирусы эукариот
Существует несколько отличий вирусов эукариот от вирусов прокариот. Эти отличия включают:
• продолжительность жизненного цикла. Литический цикл фага длится от 20 до 60 мин. Жизненый цикл вируса эукариот — от 6 до 48 ч;
• количество потомства. Фаг, содержащий ДНК, продуцирует от 50 до 1000 новых вирионов, выбрасываемых при лизисе хозяйской клетки. Эукариотические вирусы продуцируют в среднем от 500 до 100 тыс. вирионов на одно поколение клетки;
• эффективность заражения. Потомство бактериофага заразно на 100%. К счастью, большая часть потомства вирусов эукариот не в состоянии вызывать инфекцию. Количество инфицирующих вирионов может колебаться от 1/10 до 1/10 000 в популяции вируса;
• судьбу хозяйской клетки. Литический и лизогенный циклы бактериофагов, в конце концов, кончаются гибелью хозяйских клеток. У эукариот погибает только часть хозяйских клеток, в то время как остальные клетки продолжают жить и постоянно продуцировать вирус;
• нарушения функций клетки. Фаги обычно выключают репликацию ДНК клетки, синтез клеточной РНК и белка вскоре после заражения ими хозяйской клетки. Вирусы эукариот не нарушают функций хозяйской клетки до последней стадии инфекции;
• способ введения ДНК. Фаги обычно впрыскивают свою ДНК сквозь клеточную мембрану через хвосты, оставляя капсид на поверхности бактерии. Эукариотические вирусы никогда не впрыскивают свою ДНК, вместо этого в клетку входит весь вирион (и, как уже упоминалось, у эукариотических вирусов не бывает хвостов);
• частоту мутаций. Неизвестны бактериофаги, которые мутируют с большой частотой. К сожалению, существует много вирусов эукариот, мутирующих с очень высокой частотой. К ним относятся вирусы гриппа и ВИЧ-1, возбудителя СПИДа.
МЕТОДЫ ГЕНЕТИЧЕСКОГО КОНСТРУИРОВАНИЯ
К наиболее важным методам биотехнологии рекомбинантных ДНК относят следующие:
1) специфическое расщепление ДНК рестрикцирующими нуклеазами, что ускоряет выделение различных генов и манипуляции с ними;
2) быстрое секвенирование (установление последовательностей азотистых оснований в ДНК) всех нуклеотидов в очищенном фрагменте ДНК, позволяющее определить точные границы гена и кодируемую им аминокислотную последовательность полипептида;
3) гибридизацию нуклеиновых кислот, позволяющую с большой точностью выявить специфические нуклеотидные последовательности на основе их способности связывать комплементарные основания;
4) клонирование ДНК, суть которого сводится к введению ДНК-фрагмента в самореплицирующийся генетический аппарат (плазмиду или вирус), который используют для трансформации бактерий. Бактериальная клетка после трансформации способна воспроизводить этот фрагмент во многих миллионах идентичных копий;
5) генетическую инженерию, позволяющую получать модифицированные версии генов и затем внедрять их в клетки или организмы.
Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами – рестрикцирующими нуклеазами, способными разрушить чужеродную ДНК. Все ферменты можно условно разделить на следующие группы:
1) используемые для получения фрагментов ДНК;
2) синтезирующие фрагменты ДНК на матрице РНК;
3) соединяющие фрагменты ДНК;
4) позволяющие осуществить изменение структуры концов фрагментов ДНК;
5) применяемые для приготовления гибридизационных проб.
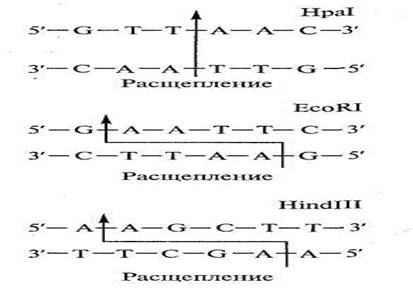
Рис. 5
Сущность генетической инженерии сводится к целенаправленному конструированию генетических систем вне организма и последующему введению их в живой организм. При этом рекомбинантные ДНК становятся составной частью генетического аппарата реципиентного организма и, кроме того, они привносят в него новые генетические и физико-биотехнологические свойства.
Один из важных этапов конструирования молекулы ДНК – лигирование (или сшивание) генов с помощью фрагмента ДНК – лигазы. Сшивание фрагментов ДНК, содержащих нужные гены, осуществляют двумя основными методами:
а) по «липким» концам;
б) с помощью искусственно достроенных «липких» концов (ферментативным путем). «Липкие» концы – взаимнокомплементарные участки, длиной из 4…6 пар нуклеотидов.
После того, как рекомбинантная ДНК сшита, ее вводят в живые клетки. Но поскольку она не способна к самовоспроизведению, ее разрушают внутриклеточные нуклеазы. Для того, чтобы рекомбинантная ДНК стала составной частью генетического аппарата клетки, она должна либо встроиться (интегрироваться) в ее геном и реплицироваться за его счет, либо быть способной к автономной репликации. Молекулы ДНК, способные акцептировать чужеродную ДНК и автономно реплицироваться, называют векторными молекулами. К числу векторов относят плазмиды, бактериофаги, вирусы животных. Векторы должны обладать следующими особенностями:
1) иметь субстратные участки для определенных эндонуклеаз рестрикции;
2) иметь свойства репликона;
3) содержать один или несколько маркерных генов, которые после проникновения вектора в клетку придают ей фенотип, свидетельствую-щий о присутствии вектора.
В частности, для бактериальных векторов в качестве маркерных генов чаще всего используются гены, вызывающие устойчивость клеток к некоторым антибиотикам.
Таким образом, все векторы обеспечивают репликацию встроенных генов, их экспрессию, интеграцию в хромосому клетки и т.д.

Рис. 6
8. Трансгенные животные - экспериментально полученные животные, содержащие во всех клетках своего организма дополнительную интегрированную с хромосомами и экспрессирующуюся чужеродную ДНК (трансген), которая передаётся по наследству по законам Менделя.

Рис. 7
Получение трансгенных животных осуществляется с помощью переноса клонированных генов (ДНК) в ядра оплодотворенных яйцеклеток (зигот) или эмбриональных стволовых (плюрипотентных) клеток. Затем в репродуктивные органы реципиентной самки пересаживают модифицированные зиготы или яйцеклетки, у которых собственное ядро заменено на модифицированное ядро эмбриональных стволовых клеток, либо бластоцисты (эмбрионы), содержащие чужеродную ДНК эмбриональных стволовых клеток. Имеются отдельные сообщения об использовании спермиев для создания трансгенных животных, однако этот приём пока не получил широкого распространения.
В настоящее время для создания трансгенных животных, кроме микроинъекций, используются другие экспериментальные приемы: инфицирование клеток рекомбинантными вирусами, электропорация, «обстрел» клеток металлическими частицами с нанесёнными на их поверхности рекомбинантными ДНК.
Все имеющиеся методы переноса генов пока ещё не очень эффективны. Для получения одного трансгенного животного в среднем необходимы микроинъекции ДНК в 40 зигот мышей, 90 зигот козы, 100 зигот свиньи, 110 зигот овцы и в 1600 зигот коровы. Механизмы интеграции экзогенной ДНК или формирования автономных репликонов (единиц репликации, отличных от хромосом) при трансгенезе не известны. Встраивание трансгенов у каждого вновь получаемого трансгенного животного происходит в случайные участки хромосом, причём может происходить встраивание как единичной копии трансгена, так и множества копий, располагающихся тандемно в единичном локусе одной из хромосом. Гомология между сайтом (местом) интеграции трансгена и самим трансгеном отсутствует. При использовании для трансгеноза эмбриональных стволовых клеток возможна предварительная селекция, что позволяет получать трансгенных животных с трансгеном, интегрированным в результате гомологичной рекомбинации с определённым участком генома хозяйского организма. С помощью этого подхода осуществляют, в частности, целенаправленное прекращение экспрессии определённого гена (это называют «нокаутом гена»).
Способы получения трансгенных микроорганизмов
Способность организмов синтезировать те или иные биомолекулы, в первую очередь белки, закодирована в их геноме. Поэтому достаточно «добавить» нужный ген, взятый из другого организма, в бактерию, которая способна расти в простых условиях и чрезвычайно быстро размножаться. Но попытки провести перенос в бактерии непосредственно геномной ДНК привели к противоречивым результатам.
Только в 70-е годы были получены воспроизводимые результаты с применением так называемой векторной трансформации. В основе этого подхода лежит использование векторных молекул – ДНК, способных переносить содержащиеся в них гены в клетку, где эти молекулы реплицируются автономно или после интеграции с геномом. Решающую роль в этих экспериментах сыграли также методы получения индивидуальных генов, наработка их в необходимом количестве путем клонирования, то есть практически неограниченного размножения в бактериальных клетках.
В основе всех достижений генетической инженерии лежит одна из особенностей строения генома бактерий – наличие у них небольших, отличных от хромосомы, кольцевых молекул ДНК, называемых плазмидами.
Плазмиды широко распространены в природе и встречаются у подавляющего числа прокариотических организмов, а также у низших эукариот –дрожжей. Важным свойством плазмид является их способность реплицироваться (размножаться) вместе с ДНК клетки хозяина, и поэтому в последнее время их считают внутриклеточными паразитами или симбионтами. Клетки хозяина не нуждаются в плазмидах для выживания в обычных условиях, но часто плазмиды придают им ряд особых свойств. Плазмиды придают бактериям способность к половому размножению (F-фактор), устойчивость к антибиотикам и дезинфицирующим средствам (R-фактор), возможности усвоения некоторых сложных органических веществ, например, углеводородов.
Рекомбинация ДНК
Генетическая рекомбинация включает несколько связанных между собой процессов, в результате которых в клетках или организмах, где они происходят, создаются новые комбинации элементов носителей генетической информации. Рекомбинация между близко расположенными гомологичными хромосомами приводит к интенсивной перетасовке отцовских и материнских генов в ходе мейоза и тем самым создает предпосылки для эволюционной проверки новых комбинаций этих генов в потомстве. Как правило, рекомбинационные события, происходящие в соматических клетках либо во время репликации ДНК, либо после нее и проявляющиеся в виде обмена сестринских хроматид, не приводят к изменению генотипа или фенотипа клетки. Однако нередко они порождают различные геномные перестройки. Это, например, утрата, приобретение или амплификация генетических элементов и установление новых взаимосвязей между уже имеющимися, но по-новому расположенными элементами.
Если использовать молекулярные термины, то можно сказать, что генетическая рекомбинация состоит в образовании ковалентных связей между нуклеотидными последовательностями из разных областей одной и той же или разных молекул ДНК.
Все клетки и многие вирусы содержат информацию о синтезе ферментов, предназначенных не только для репарации повреждений в собственной ДНК, но и ферментов, осуществляющих рекомбинацию. На самом деле некоторые ферменты, участвующие в репликации и репарации ДНК, играют ключевую роль и при рекомбинации. В этом разделе мы рассмотрим механизмы некоторых рекомбинационных процессов и ферменты, которые их катализируют. Особое внимание будет обращено на рекомбинацию у бактерий и фагов, поскольку у них эти процессы довольно хорошо изучены. Несмотря на то что генетические и морфологические аспекты рекомбинации в эукариотических клетках известны, на молекулярном уровне здесь многое остается неясным.
Основные задачи генной инженерии в создании трансгенных растений в современных условиях развития сельского хозяйства и общества довольно многообразны.
На практике ситуация выглядит следующим образом: среди промышленно выращиваемых трансгенных растений доля устойчивых к гербицидам составляет 71%, устойчивых к вредителям — 22%, устойчивых одновременно к гербицидам и вредителям — 7%, устойчивых к вирусным, 6актериальным и грибным болезням — менее 1%.
Среди главных признаков, контролируемых перенесенными генами, на первом месте стоит устойчивость к гербицидам.
Среди генов, определяющих устойчивость к гербицидам, уже клонированы гены устойчивости к таким гербицидам, как глифосат (Раундап), фосфинотрицин (Биалафос), глифосинатаммония (Баста), сульфонилмочевинным и имидозолиноновым препаратам. С использованием этих генов уже получены трансгенные соя, кукуруза, хлопчатник и т.д. В России также проходят испытания трансгенные культуры, устойчивые к гербицидам. В Центре «Биоинженерия» создается сорт картофеля, устойчивый к Басте, проходящий в настояшее время полевые испытания.
Другой распространенной группой являются трансгенные растения, устойчивые к насекомым-вредителям. Так, относительно давно известна бактерия Bacillus thuringiensis, продуцирующая белок дельта-эндотоксин, который очень токсичен для многих видов насекомых и безопасен для млекопитающих. Установлено, что встраивание гена этого белка в геном растений дает возможность получить трансгенные растения, не повреждаемые насекомыми.
Специалисты по генной инженерии в результате длительной работы подобрали необходимые штаммы Bacillus thuringiensis и создали генно-инженерные конструкции для конкретных групп насекомых.
Так, для получения трансгенного картофеля, устойчивого к колорадскому жуку, компании «Моnsanto» понадобилось 16 лет экспериментальной работы и 100 млн. долл. инвестиций.
В настоящее время компаниями «Моnsanto», «АgrEvо», «Мусоgеn» созданы другие трансгенные формы, устойчивые к насекомым, так называемые Bt-растения - соя, хлопчатник, кукуруза.
Специалисты и ученые полагают, что применение Bt –растений будет иметь не только хорошее коммерческое будущее, но и экологический эффект. Известно, что только 5% внесенного инсектицида срабатывает по назначению, остальные 95% попадают в окружающую среду, уничтожая многие виды насекомых, в том числе и полезных. Сокращение же объемов применения инсектицидов приведет к восстановлению популяций многих полезных насекомых, что, несомненно, положительно скажется на многих видах растительного и животного мира.
К третьей группе по распространенности относятся трансгенные растения, одновременно устойчивые к гербицидам и насекомым.
Площади возделывания этих культур увеличились с 0,1% в 1997 г. до 1% в 1998 г. Примерами этой группы являются кукуруза и хлопчатник, устойчивые к Раундапу и одновременно устойчивые к кукурузному мотыльку и хлопковой совке соответственно.
Менее распространенной является пока группа трансгенных культур, устойчивых к бактериальным, вирусным и грибным болезням.
Большой минус. Генетики признают, что вмешательство в геном живых организмов не может пройти бесследно, так как каждый ген в молекуле ДНК за что-то отвечает. Меняя эту совершенную структуру по своему усмотрению, человек нарушает отлаженный природой механизм. Чем это обернется в будущем, предположить очень трудно, хотя наглядный пример уже имеется. Так, генетически измененный лосось, который был выведен американскими учеными, кроме огромных размеров и внушительного веса (до 250 кг) приобрел еще одну особенность - стал ядовито-зеленого цвета. Причем такой окрас распространился не только на верхние слои кожи рыбины, но и на ее внутренние органы. Так что мутаций можно ожидать и от других «переделанных» организмов, главное - чтобы они были безобидными.
Таким образом, направления исследований генной инженерии очень разнообразны и обширны, а некоторые из них фантастичны и в то же время весьма перспективны по достижимости результатов.
9. Генномодифицированные организмы – это измененные методами генной инженерии живые организмы. В узком смысле понятие распространяется на растения. Раньше селекционерам, вроде Мичурина, приходилось добиваться определенных полезных (с точки зрения человека) свойств у растений с помощью разных ухищрений: прививок черенков одних деревьев на другие или отбора для посева семян растений только с определенными качествами, а затем долго и упорно ждать результатов, которые стойко проявлялись только через пару поколений растений. Сегодня можно перенести нужный ген в нужное место и получить желаемое.
Опасность генетически модифицированных организмов
Специалисты-противники ГМО утверждают, что они несут три основных угрозы:
Угроза организму человека – аллергические заболевания, нарушения обмена веществ, появление желудочной микрофлоры, стойкой к антибиотикам, канцерогенный и мутагенный эффекты.
Угроза окружающей среде – появление вегетирующих сорняков, загрязнение исследовательских участков, химическое загрязнение, уменьшение генетической плазмы и др.
Глобальные риски – активизация критических вирусов, экономическая безопасность.
Некоторые учёные отмечают многочисленные потенциальные опасности, связанные с продуктами генной инженерии.

Рис. 8
1. Пищевой вред
Ослабление иммунитета, возникновение аллергических реакций в результате непосредственного воздействия трансгенных белков. Влияние новых белков, которые продуцируют встроенные гены, неизвестно. Нарушения здоровья, связанные с накоплением в организме гербицидов, так как ГМ-растения имеют свойство их аккумулировать. Возможность отдалённых канцерогенных эффектов (развитие онкологических заболеваний).
2. Экологический вред
Использование генетически модифицированных растений негативно сказывается на сортовом разнообразии. Для генных модификаций берутся один-два сорта, с которыми и работают. Существует опасность вымирания многих видов растений.
Некоторые радикальные экологи предупреждают, что воздействие биотехнологий может превзойти последствия ядерного взрыва: употребление генномодифицированных продуктов ведёт к расшатыванию генофонда, в результате чего возникнут мутантные гены и их носители-мутанты.
Медики считают, что влияние генномодифицированных продуктов на человека станет явным лишь через полвека, когда сменится как минимум одно поколение людей, вскормленных трансгенной едой.
Некоторые радикальные экологи предупреждают, что многие шаги биотехнологии по своему возможному воздействию могут превзойти последствия ядерного взрыва: якобы употребление генномодифицированных продуктов ведет к расшатыванию генофонда, влекущему к появлению мутантных генов и их носителей-мутантов.
Однако, с точки зрения генетики, мы все являемся мутантами. У любых высокоорганизованных организмов определенный процент генов является мутированным. При этом большинство мутаций носит совершенно безопасный характер и никак не отражается на жизненно важных функциях их носителей.
Что же касается опасных мутаций, вызывающих генетически обусловленные заболевания, то они сравнительно хорошо исследованы. К генномодифицированным продуктам эти заболевания никакого отношения не имеют, и большинство из них сопровождает человечество с зари его появления.
Модифицированные растения
Самые распространенные ГМ-растения в мире - соя, кукуруза, масличный рапс и хлопок. В некоторых странах для выращивания одобрены трансгенные помидоры, рис, кабачки. Эксперименты проводятся на подсолнечнике, сахарной свекле, табаке, винограде, деревьях и т. д. В тех странах, где пока нет разрешения на выращивание трансгенов, проводятся полевые испытания.
Чаще всего культурные растения наделяют устойчивостью к гербицидам, насекомым или вирусам. Устойчивость к гербицидам позволяет «избранному» растению быть невосприимчивым к смертельным для других дозам химикатов. В результате поле очищается от всех лишних растений, то есть сорняков, а культуры, устойчивые или толерантные (терпимые) к гербицидам, выживают. Чаще всего компания, продающая семена подобных растений, предлагает в наборе и соответствующие гербициды. Устойчивая к насекомым флора становится поистине бесстрашной: например, непобедимый колорадский жук, съедая листик картофеля, погибает. Почти все такие растения содержат встроенный ген природного токсина - земляной бактерии Bacillus thuringiensis. Устойчивость к вирусу растение приобретает благодаря встроенному гену, взятому из этого же самого вируса.
* Первый плюс. Генная инженерия позволяет увеличивать урожайность различных сельхоз культур, поскольку при приросте мирового населения идет интенсивное обеднение земель, сокращается площадь посевов, следовательно, угроза голода по-прежнему актуальна. С помощью же генных изменений можно сделать растения более питательными, а также устойчивыми к засухе, холоду, болезням, насекомым и гербицидам. Но, вот, по поводу повышения урожайности данные никак не подтверждаются, напротив – в нескольких исследованиях есть данные о том, что ГМО-культуры имеют более низкую урожайность, чем обычные. Например, сои ГМО урождается на 5-10 % ниже, чем обычной, а сортов с повышенной питательной ценностью пока вообще нет, они только разрабатываются. Устойчивость к химикатам (гербицидам) сделала возможным увеличение опрыскивания ими полей (на 4 %), а это как ни крути для природы плохо.
* К плюсам в самом начале «пути» относили также и то, что в идеале мелкие фермеры и потребители ГМО-продуктов из бедных стран должны были почувствовать, что стоимость и производства культур, и покупки уже готовых продуктов неуклонно падает. Однако это получилось только с частью культур (пшеница), а стоимость многих семян и самих продуктов вышла дороже, чем у их натуральных собратьев поскольку гиганты агробизнеса используют ГМО-технологии прежде всего для извлечения своей прибыли. В стоимость семян, например, включены все дорогостоящие исследования, а также набавлен процент за «интеллектуальную собственность». Кроме того, ГМО-культуры не предназначены для посевов полученных с них семян, поэтому фермеры вынуждены приобретать каждый год эти семена заново.
10. Репарация (от лат. reparatio — восстановление) — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённой при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических агентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации.
Рис. 9 Повреждённые хромосомы
Механизмы репарации ДНК
В основе радиорезистентности бактерий лежат разнообразные внутриклеточные процессы, участвующие в репарации поврежденной ДНК. Большую ценность для исследования этих процессов представляет наличие хорошо охарактеризованных мутантных штаммов, радиационная чувствительность которых варьирует в чрезвычайно широких пределах.
При помощи генетических скрещиваний были получены двойные и тройные мутанты дрожжей, у которых репаративная активность полностью отсутствует. Сравнительное исследование штамма дикого типа и сверхчувствительных двойных и тройных мутантов S. сеrevisiae показало, что если нормальный штамм довольно легко переносит образование в ДНК почти 16 000 димеров (37% выживания), то двойные и тройные мутанты остаются резистентными в присутствии не более 50 и 1 димера соответственно. Пониженная резистентность таких двойных и тройных мутантов служит убедительным свидетельством в пользу существования различных путей репарации радиационных повреждений.
В зависимости от того, участвует ли видимый свет в модификации повреждений ДНК, репарацию можно подразделить на световую и темновую. Конкретно под световой репарацией понимается феномен фотореактивации, впервые описанный у актиномицетов. Механизм фотореактивации действует только на пиримидиновые димеры. В этом процессе участвует фермент фотореактивации, который связывается с димерами. Образующийся фермент-субстратный комплекс активируется видимым светом, что приводит к мономеризации димеров in situ. Таким образом, летальный эффект УФ-облучения существенно снижается, если облученные клетки подвергаются затем воздействию видимого света с длинами волн от 360 до 420 нм

Рис. 10 Световая репарация ДНК
Фотореактивация служит мощным инструментом исследования летальных и мутационных повреждений, так как их репарация под влиянием света может быть использована в качестве критерия для решения вопроса о том, обусловлена ли инактивация ДНК образованием пиримидиновых димеров.
К другому типу реактивации клеток видимым светом относится его защитное действие. В этом случае увеличение выживаемости клеток наблюдается при освещении их видимым светом перед УФ-облучением. Этот феномен объясняют тем, что видимый свет индуцирует задержку клеточного деления. В результате такой задержки остается больше времени для репарации повреждений, вызываемых УФ-облучением
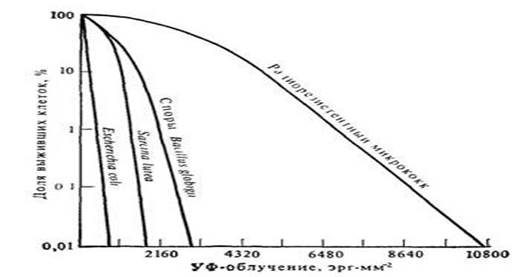
Рис. 11 Зависимость выживания клеток бактерий от величины облучения
Под «темновой репарацией» понимают репарацию без участия света. В настоящее время известны две системы такого типа: эксцизионная репарация и пострепликативная рекомбинационная репарация. Репарация первого типа требует присутствия ферментов, которые узнают нарушения структуры ДНК, удаляют затронутые участки, замещая их нормальными нуклеотидными последовательностями, и, наконец, восстанавливают первоначальную структуру ДНК, замыкая полинуклеотидную цепь

Рис. 12 Темновая репарация ДНК
11. Онтогене́з (от др.-греч. «ὤν», on, gen. «ὄντος», ontos — сущий и «γένεσις», genesis — зарождение) — индивидуальное развитие организма, совокупность последовательных морфологических, физиологических и биохимических преобразований, претерпеваемых организмом, от оплодотворения (при половом размножении) или от момента отделения от материнской особи (при бесполом размножении) до конца жизни.
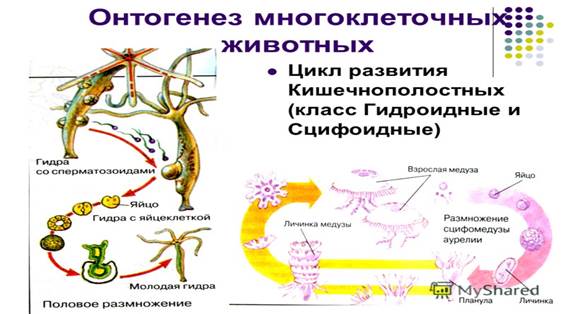
Рис. 13
Термины «онтогенез» и «филогенез» ввел в биологию зоолог Е.Геккель. Термин «онтогенез» означает процесс индивидуального развития особи, «филогенез» - история развития вида. Согласно биогенетическому закону индивидуальное развитие особи является как бы кратким повторением филогенеза. Филогенез реализуется в онтогенезе через наследственность, составляет основу онтогенеза и направляет онтогенез по пути, пройденному предками. В зиготе (оплодотворенной яйцеклетке) содержится записанная в структуре ДНК генетическая информация о развитии будущего организма. В процессе онтогенеза происходит реализация генетической информации в определенных условиях среды.
Онтогенез животных включает два основных взаимосвязанных процесса – рост и развитие. Под ростом понимают процесс увеличения размеров организма, его массы, происходящий за счет накопления в нем активных веществ. В основе роста лежит увеличение числа и размеров клеток и неклеточных образований. Под развитием понимают качественные изменения – процессы усложнения структуры организма, специализацию, дифференциацию и интеграцию его органов и тканей.
Одна из основных проблем биологии – выяснение вопроса: каким образом из одной-единственной клетки возникает множество разнообразных типов клеток, значительно различающихся между собой строением, функциями, и как в процессе онтогенеза идет формирование признаков и свойств организма? Проблема изучения механизма генетического контроля онтогенеза имеет не только теоретическое, но и практическое значение.
Влияние генов на развитие признаков. Проявление действия генов на биохимическом уровне начали изучать в 1935 году Бидл и Эфрусси. Они исследовали две рецессивные мутации окраски глаз у дрозофилы vermilion и cinnabar. У особей, гомозиготных по этим генам, не образуется пигмент, определяющий нормальную окраску глаз. Сложные глаза дрозофилы развиваются из зачатка или диска, образование которого происходит на стадии личинки. Глазной имагинальный диск можно пересадить в полость тела другой личинки, где он продолжит свое развитие. После превращения такой личинки в зрелых мух имплантированная ткань развивалась в дополнительные глаза нормальной окраски. Отсюда был сделан вывод, что в тканях мутантных мух не хватало какого-то вещества для синтеза нормальной окраски глаз.
На основании опытов Бидл и Эфрусси пришли к выводу, что образование пигмента идет по пути: предшественник → вещество 1 → вещество 2 → пигмент.Если же синтез какого-либо из веществ блокирован, то признак не проявляется. Подобную закономерность эти ученые выявили при проведении исследований на нейроспоре. В итоге, исходя из опытов, они предложили следующую модель проявления признаков у низших организмов: один ген → один фермент → один признак. По этой теории каждый ген имеет только одну первичную функцию – определять синтез только одного фермента. Изменение в структуре гена, кодирующего определенный фермент, ведет к его выключению. Впервые связь между генами и ферментами у человека обнаружил Гаррод в 1902 году. При анализе родословных больных алькаптонурией он пришел к заключению, что эта болезнь связана с обменом веществ и передается по наследству. У подав-ляющего большинства многоклеточных организмов путь от гена до признака значительно сложнее и менее изучен. Целый ряд исследований показывает, что характер индивидуального развития высших организмов определяется взаимодействием ядра и цитоплазмы, различных клеточных систем, активностью разных генов, а также влиянием условий среды.
Дифференциальная активность генов на разных этапах онтогенеза. Дифференцировка клеток – процесс, при котором во время дробления оплодотворенного яйца клетки постепенно начинают отличаться одна от другой, что приводит в конечном итоге к формированию зародыша со многими специализированными тканями. Клетки разных тканей одного и того же организма отличаются друг от друга формой, размерами и строением. Выяснение мехаизмов дифференцировки клеток – одна из главных задач современной биологии. Поскольку дифференцировка необратима, некоторые ученые считали, что в ее основе лежит неравное распределение генов в дифференцированные клетки. В настоящее время доказано, что каждая соматическая клетка имеет такой же набор хромосом, как и исходная оплодотворенная яйцеклетка. Доказательством являются опыты Дж. Гёрдона по пересадке ядер из соматических клеток в энуклеированные яйцеклетки у лягушки. Небольшой процент таких ядер обеспечивал развитие головастиков и нормальных лягушек.
В последующей работе по пересадке ядер автор показал, что в первый период эмбрионального развития в ядрах не наблюдается синтеза РНК однако в клетках синтезируются белки. Дело в том, что у животных в период роста и созревания яйцеклетки в цитоплазме накапливается большое количество молекул м- РНК, которые соединяясь с белками, образуют гранулы-информосомы. Сразу же после оплодотворения м-РНК освобождаются от белков-гистонов, поступают в рибосомы цитоплазмы где и происходит синтез белков по программе материнской ДНК. Поэтому начальный период развития зиготы осуществляется под контролем генов материнского организма. И только с начала стадии гаструляции синтез белка переходит под контроль генов развивающегося организма.
Одним из примеров дифференциальной активности генов в период онтогенеза может служить процесс формирования пуфов в политенных хромосомах дрозофилы. Было установлено, что на определенных стадиях развития отдельные диски деспирализируются и принимают форму вздутий, получивших название пуфов. При помощи использования радиоактивных изотопов было установлено, что в пуфах происходит интенсивный синтез молекул и-РНК. Разные стадии развития личинок сопровождаются активностью определенных пуфов. Это говорит о том, что на разных этапах развития вступают в действие разные гены.
О неодновременной активности различных генов может свидетельствовать изменение состава белков организма в связи с возрастом. На стадиях раннего эмбрионального развития у человека идет образование гемоглобина F, молекула которого отличается от молекулы гемоглобина А, характерного для взрослого человека по аминокислотному составу. Обнаружены также существенные возрастные различия в количестве и составе белков сыворотки крови у телят в эмбриональный период. По данным В.Холода, содержание белков в сыворотке 2-месячных телят составляет 2,62г%, затем количество их постепенно возрастает до 4,44г% у 9-месячных плодов. Изменяется и соотношение между альбуминами и глобулинами с 0,40 у 2-месячных плодов до 1,21 к моменту рождения.
Регуляция синтеза и-РНК и белка.Все клетки организма, как бы они не были дифференцированы, как правило, тождественны по генотипу. Однако клетки разных тканей любого организма отличаются по качественному и количественному составу белков. Это говорит о том, что в клетке работают не все гены сразу, а только те, которые кодируют белки и ферменты, необходимые клетке в данный момент для выполнения ее функций. Отсюда следует, что в клетке должен существовать механизм, регулирующий активность генов и обеспечивающий в нужное время синтез необходимых ей белков. На основании изучения синтеза ферментов у кишечной палочки французские генетики Ф.Жакоб и Ж.Моно предложили теорию индукции (возбуждения) и репрессии (подавления) белкового синтеза.
По их теории, гены влияющие на синтез какого либо фермента или белка, расположены в молекуле ДНК последовательно друг за другом в порядке их влияния на ход синтеза. Такие гены были названы структурными. Перед группой структурных генов расположен общий для них ген-оператор, а пред ним- промотор. В целом эта функциональная группа называется опероном. В той же молекуле ДНК на некотором расстоянии расположен ген-регулятор, под действием которого вырабатывается белок, называемый репрессором. Молекула репрессора имеет два специфических участка – один для присоединения к оператору, другой для связывания индуктора. Присоединяясь к оператору, репрессор блокирует транскрипцию. Синтез ферментов начинается под влиянием индуктора. Индуктором является определенное химическое соединение, которое служит материалом для данного фермента. Индуктор соединяется с репрессором и инактивирует его. Оператор открывается, начинается синтез и-РНК на структурных генах и соответственно синтез ферментов.
Система оперонной регуляции активности синтеза белков функционирует по принципу обратной связи. В этом случае синтез ферментов идет только до тех пор, пока конечного продукта в клетке недостаточно. Избыток продукта репрессирует синтез ферментов, участвующих в его образовании.
Механизмы регуляции у эукариот значительно сложнее и менее изучены. Это связано со сложной дифференцировкой клеток разных органов и тканей. У эукариот выявлены гены, проявляющие активность во всех клетках организма и гены, действие которых проявляется только в специализированных тканях.
У эукариот возможно одновременное групповое подавление активности генов: во всем ядре, в целой хромосоме или в большом ее участке. Предполагается, что такая репрессия генов осуществляется в значительной мере с помощью гистоновых белков. Групповое выключение активности генов в одной из Х-хромосом наблюдается в онтогенезе у самок млекопитающих, обладающих двумя Х-хромосомами. В этих хромосомах находятся гены, детерминирующие дифференцировку пола на ранних стадиях онтогенеза. Затем одна из Х-хромосом инактивируется, превращаясь в так называемое тельце Бара. Этим достигается сбалансированность эффекта генов из Х-хромосомы у самок и самцов.
Имеется много примеров, указывающих на большую роль гормонов в регуляции активности генов. Так, например, гормон щитовидной железы влияет на активность генов, обуславливающих процессы метаморфоза. При добавлении этого гормона в среду совершается быстрое превращение головастиков в лягушек. Известно, что гормон поджелудочной железы инсулин нормализует содержание глюкозы в крови.
Структура ДНК определяет химическое строение и функции белков, т.е. их качественный состав, но в процессах развития и жизни организма очень важное значение имеет и количество синтезируемого белка, а это связано с регуляцией активности генов. Установление факторов, регулирующих синтез белков, раскрыло бы широкие возможности управления онтогенезом, создание животных с более высоким уровнем продуктивности.
Влияние среды на развитие признаков. Фенотип каждого организма формируется под влиянием генотипа и условий среды. Генотип определяет норму реакции организма – границы изменчивости выражения признака под влиянием изменяющихся условий среды. Те различия, которые зависят только от условий среды, называются модификациями. Роль генотипа и определенных факторов среды в формировании разных признаков организма может быть очень различной. Есть признаки, которые в основном обусловлены генотипом. К ним относятся качественные признаки, такие как группы крови, пол организма, масть, тип конституции и др. В то же на формирование целого ряда признаков, особенно хозяйственно-полезных (удой, содержание жира и белка в молоке, яйценоскость, живая масса и др.), во многом влияют условия внешней среды.
В этом случае среда может сглаживать наследственные различия между животными, в результате чего лучшие и худшие по генотипу особи по продуктивности оказываются одинаковыми. Правильно отобрать наиболее ценных по генотипу животных можно только при оптимальных условиях среды.
Иногда под воздействием внешних факторов могут изменяться и устойчивые признаки. Например, при воздействии на кожу экстремально низкой температуры изменяется цвет волосяного покрова. На этом факте основано мечение животных с помощью жидкого азота.
Имеются наблюдения эмбриологов, говорящие о том, что резкие изменения среды в определенные периоды эмбрионального развития организма могут привести к гибели плода. Такие периоды называются критическими. Критические периоды обнаружены в онтогенезе рыб, птиц, млекопитающих и человека. Они выявляются после поздней бластулы и предшествуют основным процессам морфогенеза. У человека первый критический период относится к 1-й – началу 2-й недели после зачатия: второй – к 3-5 неделям развития, когда происходит закладка отдельных органов эмбриона человека. Третий критический период наблюдается между 8-й и 11-й неделями, когда формируется плацента. В критические периоды наблюдается чувствительность эмбриона к недостаточному снабжению кислородом и питательными веществами, ионизирующей радиации, перегреванию, охлаждению, лекарственным и ядовитым препаратам. Указанные факторы могут вызвать замедление и остановку развития, появление уродств, высокую смертность зародышей.
Date: 2016-05-25; view: 1466; Нарушение авторских прав