
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Расчеты по термохимическим уравнениям. Вычисление массы вещества по известному количеству теплоты
|
|
Пример. По термохимическому уравнению C + O2 = CO2 + 412 кДж
вычислите массу сгоревшего угля, если количество теплоты, выделившееся в результате реакции, составляет 82,4 кДж.
| Последовательность выполнения действий | Оформление решения задачи |
| С помощью соответствующих обозначений запишем условие задачи, найдем молярную массу вещества, о котором идет речь в условии задачи | Дано: Q = 82,4 кДж М(C) = 12 г/моль Qр-и = 412 кДж m(C) =? г |
| Запишем термохимическое уравнение реакции. Обозначим вопросительным знаком количество вещества, массу которого надо найти, и надпишем количество теплоты, записанное в условии задачи. Под формулой вещества обозначим стехиометрическое соотношение, вытекающее из уравнения реакции | Решение:
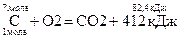
|
| Вычислим количество вещества продукта реакции. Для этого составим пропорцию |  , откуда х = 0,2
Следовательно, ν(С)= 0,2 моль , откуда х = 0,2
Следовательно, ν(С)= 0,2 моль
|
| Определим массу вещества по найденному количеству вещества. Для этого используем молярную массу вещества | m = nM m(С) = n(С)·M(С) = 0,2 моль·12 г/моль= 2,4 г |
| Запишем ответ | Ответ: m(С) = 2,4 г |
Алгоритм 8
Date: 2016-05-14; view: 2597; Нарушение авторских прав