
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Определение жесткости и мягкости молекулы
Оценка стабильности молекулы.
Энтальпия образования молекулы CHF3 из простых веществ равна:
DfH0 (CHF3) = E(CHF3) – 1/2E(C2) – 3/2E(F2)– 1/2E(H2) = -336.771638+1/2*75.37903 + 3/2*198.67776 + 1/2*1.12683 = -0,5026а.е. = -315,688 ккал/моль = -1319,5763 кДж/моль
Вывод: Молекула CH3F стабильна в стандартных условиях.
2. Свойства связей молекулы CF3H
Уточненная геометрия и порядки связей молекулы CF3H:
| Связь Å порядок связи C-F 1.317 0.945 С-H 1.074 0.950 | Валентный угол F/С\H град 110.438 |
Обычно неэмпирические расчеты в базисе 6-31G* позволяют получить геометрию молекул, подобных исследуемой (СCl4, CНF3, СНCl3), с экспериментальной точностью. Аналогичной степени точности следует ожидать и для молекулы CHF3.
Валентность атомов по Коулсону в молекуле CHF3:
ATOM ВАЛЕНТНОСТЬ
1 F 0.951
2 C 3.786
3 H 0.940
Сопоставляя длину связей в молекуле CHF3 с их порядком и валентностью атомов, можно сделать вывод: Связи в молекуле CHF3 ковалентные.
3. Энергетическая диаграмма (а.е.):
| -26.3416 | 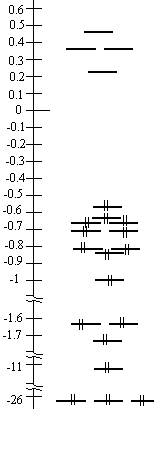
| |
| -26.3416 | ||
| -26.3416 | ||
| -11.5007 | ||
| -1.7401 | ||
| -1.6384 | ||
| -1.6384 | ||
| -0.9853 | ||
| -0.8498 | ||
| -0.8254 | ||
| -0.8254 | ||
| -0.7056 | ||
| -0.7056 | ||
| -0.6602 | ||
| -0.6602 | ||
| -0.6419 | ||
| -0.5881 | ||
| 0.2684 | ||
| 0.3631 | ||
| 0.3631 | ||
| 0.4711 |
4.Определение нуклеофильных и электрофильных свойств молекулы CHF3.
Энергия НВМО молекулы CHF3 положительна (0.2684 а.е.).
Вывод: Молекула CHF3 - нуклеофил.
Определение жесткости и мягкости молекулы.
ВЗМО молекулы CHF3 невырождена. Разница ее энергии и энергии более низколежащих МО составляет 0,0538 а.е.
Вывод: Молекула CHF3 является мягким реагентом.
Жесткость молекулы CHF3:
h =  (ЕНВМО – ЕВЗМО) = ½(0.2684+0.5881) = 0,42825 а.е.
(ЕНВМО – ЕВЗМО) = ½(0.2684+0.5881) = 0,42825 а.е.
Мягкость молекулы CHF3:
S= 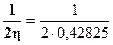 =1,1675 а.е.-1
=1,1675 а.е.-1
6. Определение положения реакционных центров.
Реакционная способность молекулы CHF3 как мягкого реагента определяется граничной плотностью электронов на атомах. Заселённость по Малликену следующая:
ATOM MUL.POP
1 F 9.345717
2 C 5.116791
3 H 0.846057
Максимальная граничная плотность электронов на атомах F.
Вывод: Атом F – наиболее вероятные центры электрофильной атаки.
7. Оценка растворимости.
Электрический дипольный момент молекулы CHF3 имеет большую величину 1.6982 D.
Вывод: Молекула CHF3 растворима преимущественно в сильно полярных растворителях (вода, спирты).
| <== предыдущая | | | следующая ==> |
| | | Кейсовое задание № 3 |
Date: 2016-05-15; view: 2113; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |