
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Гипотеза Луи де Бройля. Дифракция электронов
|
|
В 1924 году французский физик Луи де Бройль выдвинул гипотезу, что частицы вещества наряду с корпускулярными свойствами имеют также и волновые.
По идее Луи де Бройля, движение электрона или какой-либо другой частицы связано с волновым процессом, длина волны которого равна  , а частота
, а частота 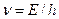 , где E – энергия частицы, p – ее импульс, m – масса частицы,
, где E – энергия частицы, p – ее импульс, m – масса частицы, 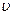 – скорость частицы, h – постоянная Планка.
– скорость частицы, h – постоянная Планка.
Экспериментальное подтверждение гипотезы Луи де Бройля было получено в опытах Г. П. Томсона (1927 г.) и независимо от него в опытах П. С. Тартаковского. В этих опытах электронный пучок проходил через тонкую золотую фольгу и попадал на фотопластинку. Электрон при ударе о фотопластинку оказывает на нее такое же действие, как и фотон. На фотопластинке была зафиксирована дифракционная картина (электронограмма золота), аналогичная рентгенограмме алюминия.
В опытах О. Штерна дифракционные явления были обнаружены также у атомных и молекулярных пучков. Во всех перечисленных выше случаях дифракционная картина соответствовала длине волны, определяемой соотношением 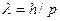 .
.
АТОМНАЯ ФИЗИКА
8.1. Модель атома Дж. Дж. Томсона. Опыт Резерфорда по рассеянию α – частиц. Планетарная модель атома. Боровская модель атома водорода. Спектры. Люминесценция
В 1903 году Дж. Дж. Томсоном была предложена модель атома, согласно которой:
1) атом представляет собой положительно заряженную сферу с вкрапленными в нее электронами; 2) суммарный заряд атома равен нулю; 3) электрон при отклонении от положения равновесия (центра атома) совершает гармонические колебания и излучает монохроматическую волну. Согласно этой модели радиус атома составляет приблизительно 3∙10-8 см.
Опыт Резерфорда по рассеянию α - частиц был проведен с целью выяснения распределения в атоме положительного и отрицательного зарядов.
Основные элементы установки Резерфорда: 1) радиоактивный препарат, испускавший α - частицы; 2) тонкая золотая фольга (толщиной несколько микрон) в качестве мишени; 3) экран, покрытый сернистым цинком, на котором возникали вспышки (сцинтилляции) при попадании α- частиц; 4) микроскоп, в который наблюдались вспышки.
Особенности α- частиц, выступавших в опыте в качестве «снарядов» для обстрела мишени: 1) большая (по атомным масштабам) масса; 2) положительный электрический заряд, равный удвоенному значению элементарного заряда; 3) большая скорость (равная 1/30 скорости света в вакууме).
Результаты опыта Резерфорда: 1) бóльшая часть α - частиц проходит сквозь вещество, не отклоняясь; 2) малая часть α - частиц отклоняется на очень большие углы (почти на 1800).
Выводы, сделанные Резерфордом на основании опыта: 1) между частицами вещества существуют большие промежутки (по атомным масштабам); 2) положительный заряд атома и его масса сконцентрированы в небольшом объеме; 3) размер атома составляет примерно 10-10 м; 4) размер ядра атома 10-14 м.
Планетарная модель атома (Резерфорд, 1911 г.): 1) в центре атома находится положительно заряженное ядро; 2) вокруг ядра обращаются электроны; 3) положительный заряд ядра равен модулю отрицательного заряда всех электронов; 4) положительный заряд ядра, выраженный в элементарных зарядах, равен порядковому номеру элемента в таблице Менделеева; 5) почти вся масса атома сосредоточена в ядре.
Недостатки планетарной модели атома: 1) непрерывное излучение электроном электромагнитных волн при движении вокруг ядра с центростремительным ускорением (согласно законам классической электродинамики); 2) потеря энергии электроном при излучении электромагнитных волн; 3) уменьшение вследствие этого радиуса орбиты электрона и непрерывное изменение при этом частоты излучения атома (непрерывный спектр излучения); 4) падение в конечном счете электрона на ядро.
Постулаты Н. Бора (1913 г): 1) в атоме существуют некоторые (стационарные) орбиты электронов, удовлетворяющие определенным квантовым условиям; находясь на стационарной орбите, электрон не излучает электромагнитных волн (света); 2) при переходе электрона с одной стационарной орбиты на другую атом излучает или поглощает квант энергии hν, где h – постоянная Планка, ν – частота излучения; энергия кванта равна разности энергий атома тех стационарных состояний, между которыми совершается квантовый скачок.
Боровская модель атома водорода (Н. Бор, 1913 г.): 1) в атоме существует состояние с наименьшей энергией (основное или нормальное состояние); 2) полная энергия атома и радиус орбиты электрона принимают дискретные (квантованные) значения; 3) линейчатый спектр составляет ряд серий, возникающих при переходах атома в одно из энергетических состояний со всех верхних энергетических состояний (состояний с большей энергией); 4) атом при поглощении света переходит из состояний с меньшей энергией в состояния с большей энергией; при этом поглощается излучение той же частоты, которую атом излучает, переходя из состояний с большей энергией в состояния с меньшей энергией.
Серии линий в излучении атома водорода: 1) серия Бальмера (при переходе на первый возбужденный уровень); 2) серия Пашена (при переходе на второй возбужденный уровень); 3) серия Лаймана (при переходе в основное состояние); 4) серия Брекета (при переходе на третий возбужденный уровень); 5) серия Пфунда (при переходе на четвертый возбужденный уровень); 6) серия Хэмфри (при переходе на пятый возбужденный уровень).
Для излучения электромагнитных волн атому необходимо сообщить определенную энергию (возбудить атом). При излучении атом теряет полученную энергию. Для непрерывного излучения света веществом необходим непрерывный приток энергии к его атомам извне.
Тепловое излучение – излучение, возникающее в случае, когда атомы вещества возбуждаются за счет их кинетической энергии теплового движения.
Спектр испускания – совокупность частот (длин волн), которые содержатся в излучении какого-либо вещества.
Спектр поглощения – совокупность частот (длин волн), поглощаемых данным веществом.
Спектры испускания и поглощения обратимы: атомы вещества интенсивно поглощают такие участки спектра, которые они излучают, будучи источниками света.
Виды спектров: 1) линейчатые; 2) полосатые; 3) сплошные.
Линейчатый спектр – спектр, представляющий собой совокупность отдельных узких спектральных линий (испускают разреженные газы, находящиеся в атомарном состоянии).
Полосатый спектр – совокупность полос (множества тесно расположенных спектральных линий), разделенных темными промежутками (испускают разреженные газы, находящиеся в молекулярном состоянии).
Непрерывный (сплошной) спектр – непрерывная последовательность частот (длин волн), плавно переходящих друг в друга (испускают твердые или жидкие тела, а также сильно сжатые газы).
Люминесценция – вид излучения, в котором энергия, необходимая атомам для излучения света, черпается из нетепловых источников.
Виды люминесценции: 1) катодолюминесценция (свечение тел, вызванное бомбардировкой вещества другими заряженными частицами); 2) электролюминесценция (свечение, вызванное пропусканием через вещество электрического тока или действием на его атомы и молекулы электрического поля); 3) хемилюминесценция (свечение, сопровождающее протекание в веществе некоторых химических реакций); 4) фотолюминесценция (свечение тел, возникающее при облучении их видимым, ультрафиолетовым светом, рентгеновским или гамма – излучением).
Date: 2016-06-09; view: 920; Нарушение авторских прав