
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химиялық коррозияның термодинамикалық мүмкін болуы
Өздігінен жүретін үдерістің жүруінің түбегейлі мүмкіндігі немесе мүмкін еместігі термодинамикалық потенциал өзгерісінің таңбасымен анықталады. Осы мақсатта критерий ретінде изобара-изотермиялық потенциалды GТ (Гиббс энергиясы) колдану ыңғайлы. Әрбір өздігінен жүретін изобара-изотермиялық үдеріс Гиббс энергиясы Δ GТ шамасының азаюымен жүреді.
Егер берілген жағдайда еркін энергияның өзгерісі Δ G< 0, онда коррозиялық үдерістің жүруі термодинамикалық мүмкін. Δ G> 0 кезінде тотығу үдерісінің жүруі мүмкін емес және олардың коррозиясының өнімдері бар болған жағдайда (мысалы, металдың тотығы немесе сульфиді) сол өнімдер диссоциацияланады. Δ G= 0 тепе-теңдік орнайды: егер тотық түзілсе, онда берілген жағдайда ол өспейді. Берілген жағдайда коррозиялық үдерістің жүру мүмкіндігі немесе мүмкін еместігі туралы мәселені шешу үшін анықтамалық мәліметтерді қолданып сәйкесінше есептеулер жүргізу қажет.
Изобаралық потенциалдың өзгерісін есептеудің ең маңызды және ортақ әдісі болып оны химиялық тепе-теңдіктің мәліметтері арқылы анықтау табылады.
Егер P,T = const келесі реакция жүреді
bB+cC+….=rR+sS
онда Гиббс энергиясының өзгерісі келесі теңдікпен анықталады
 =
=  (1)
(1)
мұндағы ΔG T — Изобаралық потенциалдың өзгерісі, кал;
R — газ тұрақтысы, 1,987 кал/град тең;
Т — абсолютті температура, ОК;
 ,
,  және т. д. – жүйенің бастапқы күйіне сәйкес реагенттердің белсенділігі;
және т. д. – жүйенің бастапқы күйіне сәйкес реагенттердің белсенділігі;
[  ,
,  и т. д.] равн — реагенттердің тепе-теңдік белсенділіктері;
и т. д.] равн — реагенттердің тепе-теңдік белсенділіктері;
 - тепе-теңдіктің термодинамикалық тұрақтысы;
- тепе-теңдіктің термодинамикалық тұрақтысы;
 - изобаралық потенциалдың стандартты өзгерісі: бастапқы және соңғы заттардың белсенділігі бірге тең болған кездегі изобаралық потенциалдың өзгерісі, кал.
- изобаралық потенциалдың стандартты өзгерісі: бастапқы және соңғы заттардың белсенділігі бірге тең болған кездегі изобаралық потенциалдың өзгерісі, кал.
Р,Т =const кезінде жүретін металдың оттегімен тотығу реакциясы үшін

(1) теңдігі келесідеу болады:
 (2)
(2)
мұндағы рО2 – жүйенің бастапқы күйіне сәйкес оттегінің парциалдық қысымы, атм;
(рО2) равн – жүйенің тепе-теңдік күйіне сәйкес оттегінің парциалдық қысымы атм;
m - тотық молекуласындағы металл атомының саны;
n - металдың валенттілігі;
Kp - химиялық тепе-теңдіктің тұрақтысы;
 - изобаралық потенциалдың стандартты өзгерісі (ΔGT 1 атм кезінде), кал.
- изобаралық потенциалдың стандартты өзгерісі (ΔGT 1 атм кезінде), кал.
(2) теңдігінен егер берілген жағдайда оттегінің парциалды қысымы рО2 тотық диссоциациясының қысынан (рО2) равн үлкен болса реакцияның жүруі мүмкін (Δ G< 0).
Бұл температурада коррозиялық үдерістің болуы туралы изобаралық потенциалдың стандартты өзгерісінің  мәні бойынша айтуға болады. Реакцияның шарты стандартты жағдайға жақын болғанына қарамастан,
мәні бойынша айтуға болады. Реакцияның шарты стандартты жағдайға жақын болғанына қарамастан,  << 0 болғанда, яғни (1) теңдікке сәйкес тепе-теңдік тұрақтысы өте үлкен болған жағдайда үдеріс түбегейлі жүруі мүмкін емес (тек стандартты жағдайда емес, басқа жағдайларда да). Себебі
<< 0 болғанда, яғни (1) теңдікке сәйкес тепе-теңдік тұрақтысы өте үлкен болған жағдайда үдеріс түбегейлі жүруі мүмкін емес (тек стандартты жағдайда емес, басқа жағдайларда да). Себебі  таңбасын басу үшін (1)теңдіктің оң жағындағы бірінші мүшесінің абсолютті мәнін қысым мен реагенттер арасындағы қатынасты практика жүзінде мүмкін емес шамаға өзгерте отырып өсіру қажет.
таңбасын басу үшін (1)теңдіктің оң жағындағы бірінші мүшесінің абсолютті мәнін қысым мен реагенттер арасындағы қатынасты практика жүзінде мүмкін емес шамаға өзгерте отырып өсіру қажет.  >> 0 кезінде реакция байқалатын дәрежеде жүрмейді. Егер
>> 0 кезінде реакция байқалатын дәрежеде жүрмейді. Егер  сандық мәні үлкен болмамса, онда бұл шаманың таңбасына тәуелсіз, үдерістің мүмкіндігі немесе мүмкін еместігі туралы қорытынды жасау үшін изобаралық потенциал өзгерісінің
сандық мәні үлкен болмамса, онда бұл шаманың таңбасына тәуелсіз, үдерістің мүмкіндігі немесе мүмкін еместігі туралы қорытынды жасау үшін изобаралық потенциал өзгерісінің  таңбасын анықтау қажет.
таңбасын анықтау қажет.
 кезінде бастапқы заттар тепе-теңдік күйге жету үшін жүйеде елеулі өзгеріске ұшырау керек.
кезінде бастапқы заттар тепе-теңдік күйге жету үшін жүйеде елеулі өзгеріске ұшырау керек.
 үшін сыртынан үрдістің мүмкіндігін немесе мүмкін еместігін анықтауға болатын нақты шектерді алу қиынға түседі. Кейбіреулер [
үшін сыртынан үрдістің мүмкіндігін немесе мүмкін еместігін анықтауға болатын нақты шектерді алу қиынға түседі. Кейбіреулер [  бағдарлы шамасын нұсқайды.
бағдарлы шамасын нұсқайды.
Металдардың оттегімен тотығу реакциялары үшін -11,4 Т  қабылдауға болады.
қабылдауға болады.  (металдың кал/г-экв) бұл шектес мәндері оттегінің парциалдық қысымының рО2 10-10 нан 104 атм-ға дейін өзгеру мүмкіндігінің болжалды шегінен алынған.
(металдың кал/г-экв) бұл шектес мәндері оттегінің парциалдық қысымының рО2 10-10 нан 104 атм-ға дейін өзгеру мүмкіндігінің болжалды шегінен алынған.
Стандартты изобаралық потенциал өзгерісінің температураға тәуелділігі келесідей өрнектеледі:
 (3)
(3)
мұндағы ΔH0 - интегралдау тұрақтысы (абсолютті нөл кезіндегі гипотезалық жылулық эффект), кал;
ΔCp - стехиометриялық коэффициенттерді ескере алынған реакция өнімдері мен бастапқы заттардың мольдік изобаралық жылусыйымдылықтары айырмаларының қосындысы, кал/град;
I – интегралдау тұрақтысы, кал/град;
Δa, Δb, Δc и Δс' – стехиометриялық коэффициенттерді ескере алынған реакция өнімдері мен бастапқы заттар үшін жылусыйымдылық теңдігіндегі сәйкес коэффициентердің айырмаларының қосындысы.
 (4)
(4)
(3) теңдік бойынша  есептеу үшін келесілерді білу керек:
есептеу үшін келесілерді білу керек:
А) барлық реагенттер үшін СР Т-ға тәуелділігі:
Б) келесі теңдікпен анықталатын ΔH0 шамасы
 (5)
(5)
Ол үшін тым болмаса реакцияның жылулық эффектісінің ΔHT бір мәні белгілі болуы керек.
В) (3) теңдіктің интегралдау тұрақтысы I, ол үшін тым болмаса бір температурадағы  (немесе Kp) мәнін болу керек.
(немесе Kp) мәнін болу керек.
 мәні реакцияның жылулық эффектісінің және реакция энтропиясының станндартты өзгерісінің мәндерінен келесі теңдік арқылы анықтауға болады.
мәні реакцияның жылулық эффектісінің және реакция энтропиясының станндартты өзгерісінің мәндерінен келесі теңдік арқылы анықтауға болады.
 (6)
(6)
мұндағы  - 2980 К кезіндегі изобаралық потенциалдың стандартты өзгерісі;
- 2980 К кезіндегі изобаралық потенциалдың стандартты өзгерісі;
 - 2980 К кезіндегі реакцияның стандартты жылулық эффектісі;
- 2980 К кезіндегі реакцияның стандартты жылулық эффектісі;
 - 2980 К кезіндегі реакция энтропиясының стандартты өзгерісі.
- 2980 К кезіндегі реакция энтропиясының стандартты өзгерісі.
Анықтамалық мәліметтерде кейбір элементтердің, қарапайым заттардың және қосылыстардың жылусыйымдылықтары, түзілу жылуларының стандартты шамалары, изобаралық потенциалдары және энтропиялары келтірілген. Олар металдардың химиялық коррозиясының термодинамикалық мүмкіндігін анықтау үшін қолданылуы мүмкін.
 мәнін келесі теңдік арқылы табуға болады.
мәнін келесі теңдік арқылы табуға болады.
 (7)
(7)
Теңдіктің соңғы мүшесі Сp=f(T) тәуелділігі арқылы анықтауға болады. Егер ол Cp = ∆a + ∆bT + ∆cT2 +  , дәрежелік қатармен өрнектелсе, онда есептеуді жеңілдету үшін М.И. Темкин және Л.А. Шварцман әдісін қолдануға болады. Оған келесі өлшемдерді енгізген кезде
, дәрежелік қатармен өрнектелсе, онда есептеуді жеңілдету үшін М.И. Темкин және Л.А. Шварцман әдісін қолдануға болады. Оған келесі өлшемдерді енгізген кезде
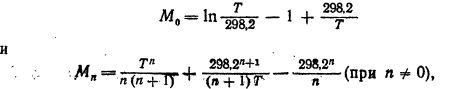
n = 1, 2 және -2, (7) теңдік келесідей өрнектеледі:
 (8)
(8)
Әр түрлі температурадағы М0, М1, М2 және М-2 мәндері анықтамалықтарда келтірілген.
Date: 2016-02-19; view: 774; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |