
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Общие пути обмена аминокислот
|
|
Пути распада аминокислот до конечных продуктов можно разделить на 3 группы:
1. Пути распада, связанные с превращением NH2-групп.
2. Декарбоксилирование  -СООН групп.
-СООН групп.
3. Превращения углеродного скелета аминокислот.
Превращение  -аминогрупп аминокислот.
-аминогрупп аминокислот.
В тканях организма происходит отщепление аминогрупп с образованием аммиака. Этот процесс называется дезаминированием. Возможны 4 типа дезаминирования:
1. Восстановительное
R-CH-COOH 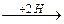 R-CH2-COOH + NH3
R-CH2-COOH + NH3
|
NH2
2. Гидролитическое
R-CH-COOH 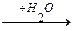 R-CH-COOH + NH3
R-CH-COOH + NH3
| |
NH2 OH
3. Внутримолекулярное
R-CH2-CH-COOH  R-CH=CH-COOH + NH3
R-CH=CH-COOH + NH3
|
NH2
4. Окислительное
R-CH-COOH 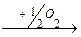 R-C-COOH + NH3
R-C-COOH + NH3
| ||
NH2 O
Окислительное дезаминирование бывает 2 видов: прямое и непрямое (трансдезаминирование).
Прямое окислительное дезаминирование осуществляется оксидазами. В качестве кофермента содержат ФМН или ФАД. Продуктами
реакции являются кетокислоты и аммиак.
Трансдезаминирование – основной путь дезаминирования аминокислот. Трансдезаминирование проходит в 2 этапа.
Первый – трансаминирование – перенос аминогруппы с любой аминокислоты на  -кетокислоту без промежуточного образования аммиака;
-кетокислоту без промежуточного образования аммиака;
Второй – собственно окислительное дезаминирование.
В результате первого этапа аминогруппы «собираются» в составе глутаминовой кислоты. Второй этап связан с окислительным дезаминированием глутаминовой кислоты.
Трансаминирование аминокислот было открыто советскими учеными Браунштейном и Крицман (1937г).
R R1 R R1
| | | |
HC-NH2 + C=O 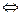 C=O + HC-NH2
C=O + HC-NH2
| | | |
COOH COOH COOH COOH
Реакция трансаминирования обратима, она катализируется ферментами – аминотрансферазами.
Акцептором аминогрупп в реакциях трансаминирования являются три  - кетокислоты: пируват, оксалоацетат, 2-оксоглутарат. Наиболее часто акцептором NH2-групп служит 2-оксоглутарат (
- кетокислоты: пируват, оксалоацетат, 2-оксоглутарат. Наиболее часто акцептором NH2-групп служит 2-оксоглутарат (  -кетоглутарат), реакция приводит к образованию глутаминовой кислоты:
-кетоглутарат), реакция приводит к образованию глутаминовой кислоты:
1. СН3 COOH CH3 COOH
| | АЛТ | |
НСNH2 + CH2  C=O + (CH2)2
C=O + (CH2)2
| | | |
COOH CH2 COOH CHNH2
| |
C=O COOH
| глутамат
COOH
Аминотрансферазы содержат в качестве кофермента производные пиридоксина (витамин В6) – пиридоксаль-фосфат и пиридоксамин-фосфат.
(Механизм реакции трансаминирования с участием пиридоксальфосфата – учебник.)
2. Окислительное дезаминирование глутаминовой кислоты.
Биологический смысл реакций трансаминирования состоит в том, чтобы собрать аминогрупы всех распадающихся аминокислот в составе одной аминокислоты – глутаминовой. Глутаминовая кислота поступает в митохондрии клеток, где происходит второй этап трансдезаминирования – собственно дезаминирование глутаминовой кислоты. Реакция катализируется глутаматдегидрогеназой, которая в качестве кофермента содержит НАД+ или НАДФ+.
COOH СООН
| |
 (CH2)2
(CH2)2 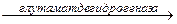 (CH2)2
(CH2)2
| |
CHNH2 НАД НАДН+Н+ C=O
| |
COOH COOH
Клиническое значение определения активности трансаминаз.
Для клинических целей определяют активность АлТ и АсТ, которые катализируют следующие реакции:
Аспартат +  -кетоглутарат
-кетоглутарат 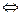 оксалоацетат + глутамат
оксалоацетат + глутамат
Аланин +  -кетоглутарат
-кетоглутарат 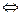 пируват + глутамат
пируват + глутамат
В сыворотке крови здоровых людей активность этих трансаминаз ниже, чем в органах. При поражении органов наблюдается выход трансаминаз из очага поражения в кровь. Так, при инфаркте миокарда уровень АсТ сыворотки крови уже через 3-5 ч после наступления инфаркта повышается в 20-30 раз. При гепатитах повышается более умеренное и затяжное.
Декарбоксилирование аминокислот.
Процесс отщепление карбоксильной группы в виде СО2 называется декарбоксилированием и приводит к образованию биогенных аминов, которые оказывают фармакологическое действие на физиологические функции человека.
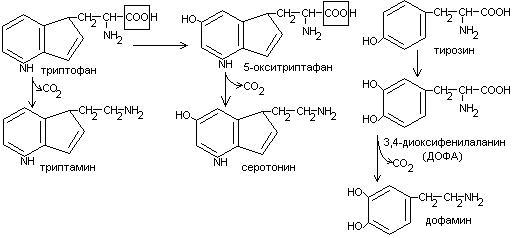
Серотонин обладает сосудосуживающим действием, участвует в регуляции артериального давления, t тела, дыхания, медиатор нервных процессов.
Дофамин- предшественник катехоламинов.
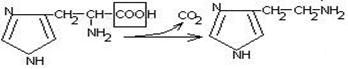
гистидин гистамин
Гистамин обладает сосудорасширяющим действием. Он образуется в области воспаления, участвует в развитии аллергических реакций.
НООС-(СН2)2-СН-СООН 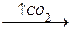 СН2-СН2-СН2-СООН
СН2-СН2-СН2-СООН
| |
глутамат NH2 NH2 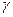 -аминомасляная кислота (ГАМК)
-аминомасляная кислота (ГАМК)
ГАМК является тормозным медиатором. В лечебной практике используется при лечении эпилепсии (резкое сокращение частоты припадков).
Орнитин декарбоксилируясь дает диамин – путресцин, а лизин – кадаверин.
СН2-СН2-СН2-СН-СООН 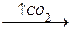 СН2-СН2-СН2-СН2-NH2;
СН2-СН2-СН2-СН2-NH2;
| | |
NH2 NH2 NH2
CH2-CH2-CH2-CH2-CH-COOH 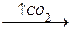 СН2-СН2-СН2-СН2-CH2-NH2
СН2-СН2-СН2-СН2-CH2-NH2
| | |
NH2 NH2 NH2
В организме биогенные амины подвергаются реакции окислительного дезаминирования с образованием альдегидов и аммиака. Процесс осуществляется при участии моноаминооксидаз.
Схематически механизм трансдезаминирования можно представит так:

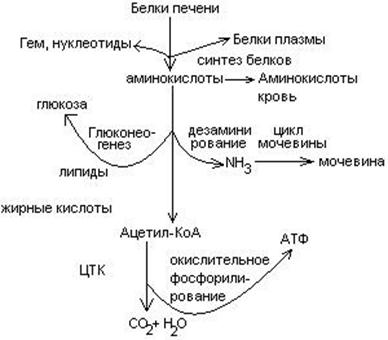
Пути превращения аминокислот в печени.
Включение углеродных скелетов аминокислот в цикл лимонной кислоты.
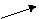
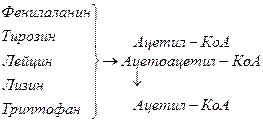
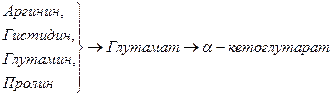
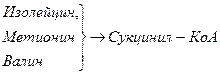
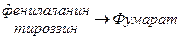
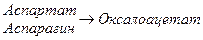
Date: 2015-05-23; view: 853; Нарушение авторских прав