
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева
|
|
I. Электрон вращается вокруг ядра атома с невообразимой скоростью.
- Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собой электронное облако.
- Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
- Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
| Виды электронных орбиталей | Форма орбитали в пространстве | Количество орбиталей в атоме.
Условное обозначение орбитали – клетка:
| |||||||
| s – орбиталь (электронное облако s – электрона) |
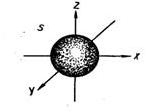 сфера (шар)
сфера (шар)
| Электронное облако такой формы может занимать в атоме одно положение
(условное обозначение) | |||||||
| p – орбиталь (электронное облако p – электрона) | гантель (восьмёрка) | Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z.
(условное обозначение)
| |||||||
| d – орбиталь (электронное облако d – электрона) | четырёхлепестковая форма | Все d -орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре.
(условное обозначение) | |||||||
| f – орбиталь (электронное облако f – электрона) | сложная форма | Электронное облако такой формы может занимать в атоме семь положений.
(условное обозначение) |
- II. Условное обозначение электрона – стрелка, направленная вверх ↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз ↓ (электрон вращается вокруг собственной оси против часовой стрелки).
- Число электронов в атоме определяют по порядковому номеру
- О – 8 электронов, S – 32 электрона.
- На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
| ↑↓ |
- Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
- III. Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
- Условное обозначение уровня - скобка:
- )
- Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
- О – 2 уровня, S – три уровня.
- IV.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
V.
Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
Date: 2015-05-22; view: 918; Нарушение авторских прав