
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Фотометрия. · Дифференциальный метод
|
|
· Дифференциальный метод
В качестве раствора сравнения мы выбираем наименьшей концентрации Co определенного компонента. За нулевой раствор берется первая точка градуировочного графика. Используется при анализе веществ с большой концентрацией, а также для устранения мешающих влияния посторонних примесей. У этого метода есть и расчетный вариант:
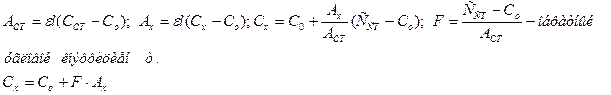
· Метод градировочного графика
Используется при неточных анализах, и когда содержание вещества в пробах может быть различным в широком интервале концентраций.
Для построения градуировочного графика готовят серию стандартных растворов.
Требования к стандартным растворам:
1) Должны охватывать весь интервал ожидаемых концентраций исследуемого раствора, при этом желательно, чтобы оптическая плотность исследуемого раствора лежала примерно в центре графика, т.к. воспроизводимость немного выше.
2) Должен выполнятся закон БЛБ (т.е. сохранятся линейность графика)
3) Интервал оптических плотностей стандартный растворов должен лежать в интервале от 0,1 до 1 для наилучшей воспроизводимости опыта.
При качественном обнаружении плотность может быть>1
Y=bc+a, b – tgα (угловой коэффициент). Чем tgα больше, тем метод более чувствителен.
Если в поглощающей системе наблюдается 2 max поглощения(экстремумы) то строят 2 градировочных графика при этих длинах волн. Какой график пойдет круче, ту длину волны выбирают в качестве оптимальной.
1) Примеси, имеющиеся в реагентах, имеют свое поглощение
2) Неправильно выбранный раствор сравнения(например, в качестве раствора сравнения нужно было взять «холостой» опыт, а мы взяли обычный растворитель.)
Из каждой точки графика можно вычесть величину а. С градуировочного графика работают, если α≥15º
Если линейность графика соблюдается плохо, нужно готовить больше стандартных растворов, чтобы концентрация каждого отличалась не больше, чем на 10%.
· Фотометрические методы определения концентрации.
Делятся на абсолютные и дифференциальные. Абсолютные(расчет по молярному коэффициенту светопоглощения, метод сравнения оптических плотностей стандартного и исследуемого раствора, метод градуировочного графика) - аналитический сигнал фиксируется по сравнению с нулевым раствором, не содержит определяемый компонент. Используют растворители холостой опыт простой раствор реагента. Дифференциальный метод применяется, когда в качестве раствора сравнения берем какой-либо стандартный раствор определяемого компонента(в качестве нулевого раствора исп. Минимальную концентрацию. Метод исп., когда концентрация компонента велика.
· Нулевой раствор сравнения.
Оптич. Плотность нулевого раствора принимается равной 0. Выбор расвора осуществляется согласно закону аддитивности. 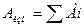 (закон сложенияJ
(закон сложенияJ
Отклонения от з-на БЛБ: кажущиеся физические и химические отклонения. Истинные отклонения связаны с изменением коэффициента преломления n, в свою очередь n зависит от концентрации в-ва в растворе. В фотометрии исп. 10-3- 10-5 молярность=> отклонением можно принебречь. Кажущиеся физич. Отклонения связаны с несовершенством прибора, обусловлено немонохроматичностью светового потока, рассеиванием света и случайными излучениями. Кажущиеся хим.: 1. от влияния посторонних электролитов происходит деформация молекул или заряженных частиц поглощающего в-ва, что ведет к изменению спектральных хар-к в-ва. 2. при изменении концентраций раствора меняется сила взаимодействия частиц в нем, при увиличении- возможен процесс полимеризации, при уменьшении- диссоциации и деполимеризации. 3. изменение степени сольватации(гидротации). Зависит от концентрации р-ра. Влияние концентрации ионов Н проявляется а. если реагент обладает кислотными св-ми, то полнота образования окрашенного комплексного соединения зависит от рН р-ра. б. под влиянием конценрации ионов Н меняется форма существования частиц в р-ре. в. При изменении рН р-ра может меняться состав комплексов.
Вариант
Date: 2015-05-18; view: 728; Нарушение авторских прав