
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теоретические сведения. Цель работы - ознакомиться со спектрами излучения атомарных газов; провести качественный эмиссионный спектральный анализ
|
|
ЛАБОРАТОРНАЯ РАБОТА № 3.4
ИЗУЧЕНИЕ СПЕКТРАЛЬНЫХ ЗАКОНОМЕРНОСТЕЙ ИЗЛУЧЕНИЯ АТОМОВ
Цель работы - ознакомиться со спектрами излучения атомарных газов; провести качественный эмиссионный спектральный анализ.
Оборудование: монохроматор, набор спектральных разрядных трубок, блок питания разрядных трубок.
Теоретические сведения
По современным представлениям атом любого вещества состоит из ядра, заряженного положительно, и электронов, несущих отрицательный заряд. Электроны в атоме совершают сложное движение, которое только в первом приближении можно представить как вращение по эллиптическим орбитам вокруг ядра.
Каждый электрон вследствие своего движения и взаимодействия с ядром и другими электронами обладает определенным значением энергии Е, механического момента импульса L, связанного с движением электрона
по орбите и магнитного орбитального момента ml. Кроме орбитальных, электрон имеет также и. собственные (спиновые) механический Ls, магнитный ms –моменты. Bce эти величины могут принимать только дискретные значения, т.е. можно сказать, что величины, описывающие состояние электрона в атоме, квантуются.
Состояние каждого электрона в атоме характеризуется определенными
значениями четырех квантовых чисел n, l, ml, ms. Эти числа называются: n - главное квантовое число; l - орбитальное квантовое число; ml - орбитальное магнитное (или просто магнитное) квантовое число; ms - спиновое магнитное (или просто спиновое) квантовое число. Величина энергии электрона определяется в основном значением главного квантового числа n, которое может принимать только целые значения: 1,2, … ¥. В простейшем случае атома водорода энергия электрона полностью определяется значением главного квантового числа.
Орбитальное квантовое число l определяет величину орбитального момента импульса электрона. Модуль вектора орбитального момента импульса электрона:
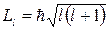 , где
, где 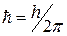
По теории Бора l определяет форму эллиптической орбиты электрона. При данном n орбитальное квантовое число может принимать целые
значения от нуля до (n- 1): 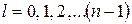 .
.
В атомной физике применяются условные обозначения состояний электрона с различными значениями момента импульса. Электрон, находящийся в состоянии с l = 0, называют s - электроном (соответствующее состояние - s -состоянием), l = 1 - р электроном, l = 2 - d -электроном, l = 3 - f - электроном и т.д. Значение главного квантового числа указывается перед условным обозначением квантового числа l. Например, электрон в состоянии с n = 3 и l =1 обозначается З р.
Магнитное квантовое число ml (определяет проекцию орбитального момента на какое-нибудь выделенное направление 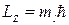 (обычно на ось z). При данном значении l магнитное квантовое число может принимать значения: 0, ± 1, ±2,..., + l -всего (2 l +1)значений.
(обычно на ось z). При данном значении l магнитное квантовое число может принимать значения: 0, ± 1, ±2,..., + l -всего (2 l +1)значений.
Величина собственного момента импульса электрона (спина) равна:
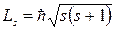
где спиновое квантовое число S имеет одно единственное значение S = 1/2.
Спиновое магнитное квантовое число ms, определяет проекцию спина электрона на выделенное направление и может принимать лишь два
значения ± 1/2: 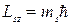
Согласно принципу Паули, в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел: n, l, ml, ms, т.е. в одном и том же состоянии не могут находиться одновременно два электрона.
В атоме распределение электронов по энергетическим состояниям должно удовлетворять принципу минимума потенциальной энергии: с возрастанием числа электронов каждый следующий электрон должен занять возможное энергетическое состояние с наименьшей энергией. Заполнение электронами энергетических состояний в атоме должно происходит в соответствии с принципом Паули.
В состояниях с данным значением главного квантового числа могут находиться в атоме не более электронов:
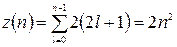
Электроны в атоме, занимающие совокупность состояний с одинаковым n, образуют электронную оболочку. В каждой из оболочек электроны распределяются по подоболочкам, соответствующим данному l. Для полностью заполненной подоболочки характерно равенство нулю суммарного орбитального и спинового моментов электронов. Поэтому значения механического и магнитного моментов атома вещества определяются суммарными значениями соответствующих величин для электронов, входящих в незаполненную подоболочку (валентных электронов). Валентные электроны определяют химические и многие физические (в частности, магнитные, оптические) свойства вещества.
Рассмотрим, например, атом лития. В состоянии с n = 1 могут находиться только 2 электрона с анипараллельной ориентацией спинов (l = 0, ms = ±1/2)- Третий электрон атома лития может занять лишь уровень с n =2 (2 s - электрон). Этот электрон, занимая более высокий энергетический уровень, оказывается слабее связан с ядром атома, чем 1 s - электроны; он и определяет физические и химические свойства атома лития (см. приложение).
Возможные значения энергии атома, называются энергетическими уровнями. Самый нижний уровень, соответствующий наименьшей возможной энергии, называется основным, а все остальные — возбужденными,т.к. для перевода на них электрона с основного уровня атом надо возбудить - сообщить ему энергию.
Оптические спектры возникают в результате переходов валентных электронов в атомах и молекулах из одного энергетического состояния в другое. Частота испускаемого при переходе излучения:
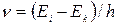
где Ei - энергия одного из уровней возбужденного состояния электрона в атоме; Ek - энергия более низкого уровня.
Вид спектра зависит от расположения энергетических уровней атомов. Набор линий в спектре, их расположение и интенсивность являются индивидуальным свойством атома. Это свойство используют для анализа атомного состава вещества.
Спектр испускания разреженных атомарных газов и их паров, представляющих собой совокупность невзаимодействующих атомов, - линейчатый т.е. состоит из отдельных узких линий, соответствующих частотам, характерным для атомов данного газа. Энергия кванта очень мала, но переход из возбужденного состояния, сопровождающийся испусканием энергии, происходит одновременно в огромном числе атомов. Поэтому яркость спектральных линий достаточна для наблюдения.
Не следует, однако, думать, что возможны любые переходы электронов, т.е. переходы с данного возбужденного уровня на любой из нижележащих. Существуют правила отбора (запрета), определяющие вероятность данного перехода. Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центрально симметричном поле ядра, могут осуществляться только такие переходы для которых, в соответствии с законом сохранения момента импульса:
1) изменение орбитального квантового числа Dl удовлетворяет условию:
D l = ±1;
изменение магнитного квантового числа Dml удовлетворяет условию:
Dml = 0, ±1.
В оптических спектрах указанные правила отбора в основном выполняются. Поэтому интенсивность данной спектральной линии тем больше, чем больше вероятность перехода электронов между соответствующими энергетическими уровнями.
Возбуждение атомов осуществляется разными путями. Один из них заключается в использовании газового разряда. К электродам газоразрядной трубки, заполненной разреженным газом, прикладывается высокое напряжение. Заряженные частицы, имеющиеся в газе, разгоняются электрическим полем, сталкиваются с нейтральными атомами и передают им свою энергию. В результате атомы либо ионизируются, либо переходят в возбужденное состояние.
В данной работе студентам предлагается провести качественный эмиссионный анализ газов.
Date: 2015-05-18; view: 425; Нарушение авторских прав