
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния
|
|
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
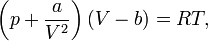
где
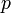 — давление,
— давление,
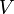 — молярный объём,
— молярный объём,
 — абсолютная температура,
— абсолютная температура,
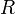 — универсальная газовая постоянная.
— универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка 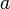 учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, т.к. есть силы, втягивающие молекулы приграничного слоя внутрь), поправка 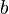 — силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
— силы отталкивания (из общего объёма вычитаем объём, занимаемый молекулами).
Для 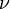 молей газа Ван -дер-Ваальса уравнение состояния выглядит так:
молей газа Ван -дер-Ваальса уравнение состояния выглядит так:
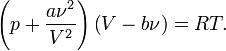 Где
Где 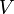 — объём,
— объём,
Изотерма линия на диаграмме состояния, изображающая процесс, происходящий при постоянной температуре (изотермический процесс). Уравнение Изотерма идеального газа pV = const, где р — давление, V — объём газа. Для реального газа уравнение Изотерма имеет более сложный характер и переходит в уравнение Изотерма идеального газа только при малых давлениях или высоких температурах.
На рис. 2.8 схематически изображены изотермы газа Ван-дер-Ваальса для различных температур.
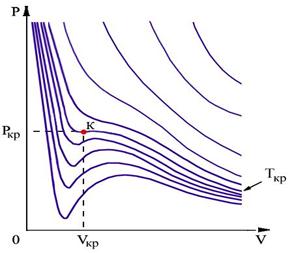 Рис. 2.8.Изотермы газа Ван-дер-Ваальса Рис. 2.8.Изотермы газа Ван-дер-Ваальса
|
На этих изотермах хорошо просматривается участок, где давление растёт с ростом объёма. Этот участок не имеет физического смысла. В области, где изотерма делает зигзагообразный изгиб, изобара пересекает её три раза, то есть, имеется три значения объёма 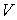 при одинаковых значениях параметров
при одинаковых значениях параметров 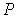 и
и 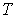 . При повышении температуры волнообразный участок уменьшается и превращается в точку (см. точка К на рис. 2.8). Эта точка называется критической, а значения
. При повышении температуры волнообразный участок уменьшается и превращается в точку (см. точка К на рис. 2.8). Эта точка называется критической, а значения 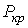 ,
,  и
и 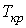 в этой точке называются критическими параметрами. При температурах, превышающих критическую, изотермы Ван-дер-Ваальса становятся монотонно убывающими функциями
в этой точке называются критическими параметрами. При температурах, превышающих критическую, изотермы Ван-дер-Ваальса становятся монотонно убывающими функциями 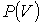 .
.
Критические параметры 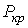 ,
,  и
и 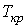 можно найти из условия, что в критической точке изотерма Ван-дер-Ваальса имеет как экстремум, так и точку перегиба. Таким образом, из уравнения состояния газа Ван-дер-Ваальса следует существование у реальных газов критической точки с параметрами
можно найти из условия, что в критической точке изотерма Ван-дер-Ваальса имеет как экстремум, так и точку перегиба. Таким образом, из уравнения состояния газа Ван-дер-Ваальса следует существование у реальных газов критической точки с параметрами 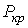 ,
,  и
и 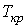 , величина которых зависит от свойств газа.
, величина которых зависит от свойств газа.
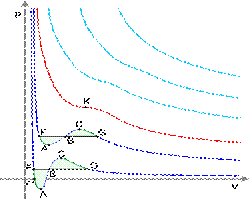 Изотермы реального газа (схематично)
Изотермы реального газа (схематично)
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния.
Участок левее точки F — нормальная жидкость.
Точка F — точка кипения.
Прямая FG — равновесие жидкой и газообразной фазы.
Участок FA — перегретая жидкость.
Участок F′A — растянутая жидкость (p<0).
Участок AC — аналитическое продолжение изотермы, физически невозможен.
Участок CG — переохлаждённый пар.
Точка G — точка росы.
Участок правее точки G — нормальный газ.
Площади фигуры FAB и GCB равны.
Красная — критическая изотерма.
K — критическая точка.
Голубые — сверхкритические изотермы
Поскольку весь процесс происходит при постоянной температуре T, кривую, что изображает зависимость давления р от объёма V, называют изотермой. При объёме V1 начинается конденсация газа, а при объёме V2 она заканчивается. Если V > V1 то вещество будет в газообразном состоянии, а при V < V2 — в жидком.
Опыты показывают, что такой вид имеют изотермы и всех других газов, если их температура не очень высокая.
В этом процессе, когда газ превращается в жидкость при изменении его объёма от V1 к V2, давление газа остаётся постоянным. Каждой точке прямолинейной части изотермы 1—2 соответствует равновесие между газообразным и жидким состояниями вещества. Это означает, что при определённых T и V количество жидкости и газа над ней остаётся неизменным. Равновесие имеет динамический характер: количество молекул, которые покидают жидкости, в среднем равняется количеству молекул, которые переходят из газа в жидкость за одно и то же время.
Также существует такое понятие как критическая температура, если газ находится при температуре выше критической (индивидуальна для каждого газа, например для углекислого газа примерно 304 К), то его уже невозможно превратить в жидкость, какое бы давление к нему не прилагалось. Данное явление возникает вследствие того, что при критической температуре силы поверхностного натяжения жидкости равны нулю. Если продолжать медленно сжимать газ при температуре большей критической, то после достижения им объёма, равного приблизительно четырем собственным объёмам молекул, составляющих газ, сжимаемость газа начинает резко падать.
4.10.
Внутренняя энергия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю энергию тела нельзя измерить напрямую. Можно определить только изменение внутренней энергии:
 где
где
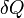 — подведённая к телу теплота, измеренная в джоулях
— подведённая к телу теплота, измеренная в джоулях
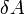 ] — работа, совершаемая телом против внешних сил, измеренная в джоулях
] — работа, совершаемая телом против внешних сил, измеренная в джоулях
Эта формула является математическим выражением первого начала термодинамики
Для квазистатических процессов выполняется следующее соотношение:
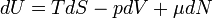 где
где
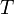 — температура, измеренная в кельвинах
— температура, измеренная в кельвинах
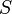 — энтропия, измеренная в джоулях/кельвин
— энтропия, измеренная в джоулях/кельвин
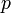 — давление, измеренное в паскалях
— давление, измеренное в паскалях
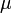 — химический потенциал
— химический потенциал
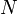 — количество частиц в системе
— количество частиц в системе
Date: 2015-05-18; view: 670; Нарушение авторских прав