
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Газ Ван-дер-Ваальса
|
|
С ростом давления уравнение состояния идеального газа требует корректировки при описании поведения реальных газов. При р = 1000 атм (108 Па) произведение р.V становится вдвое больше, чем предписывает модель идеального газа для конкретной температуры (газ не «сжимается»).
Причин для такого отклонения две:
1) собственный размер молекул, уменьшающий объём, доступный для движения молекул (при нормальных условиях он составляет ~ 0,07% объёма сосуда с газом, а при 100 атм уже 70%);
 2) сложный характер взаимодействия между молекулами.
2) сложный характер взаимодействия между молекулами.
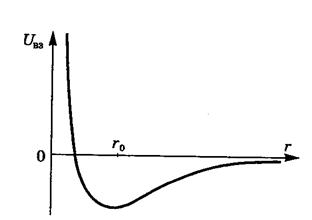
На рисунке приведена типичная кривая зависимости потенциальной энергии взаимодействия U ВЗ молекул от расстояния между их центрами.
На малых расстояниях (r < r o) молекулы отталкиваются, на больших (r > r o) притягиваются.
Для описания реального (неидеального) газа пользуются уравнением Ван-дер-Ваальса:
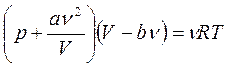 , где
, где
a и b – постоянные Ван-дер-Ваальса (для разных газов они имеют свои значения).
Поправка 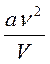 обусловлена силами притяжения между молекулами. Она имеет размерность давления, и её иногда называют внутренним давлением.
обусловлена силами притяжения между молекулами. Она имеет размерность давления, и её иногда называют внутренним давлением.
Поправка b связана с собственным объёмом молекул.
Date: 2015-05-09; view: 838; Нарушение авторских прав