
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Раствор перекиси водорода 3 %-ный
Состав: пергидроля 10,0,
бензоат натрия (стабилизатор) 0,05, воды до 100,0.
Определение подлинности
Перекись водорода. К 0,5 мл препарата прибавляют 2—3 капли разведенной серной кислоты, 1—2 мл эфира, 3—4 капли раствора бихромата калия и взбалтывают. Эфирный слой окрашивается в синий цвет (надхромовая кислота).
Н202 + К2Сг207 + H2SO4 = K2SO4 + Н20 + H2Cr208.
надхромовая кислота
Бензоат натрия. 30 мл препарата упаривают до 2 мл и вносят 3—5 капель 5 %-ного раствора сульфата, образуется осадок буро-зеленого цвета.
При приготовлении 3 %-ного раствора перекиси водорода рекомендуется добавлять в качестве стабилизатора 0,05 %-ного бензоата натрия.
Количественное определение Перекись водорода
1. ПЕРМАНГАНАТОМЕТРИЧЕСКИЙ МЕТОД основан на восстановительных свойствах перекиси водорода: 5 мл препарата помещают в мерную колбу емкостью 500 мл и доводят объем водой до метки, перемешивают (раствор А). К 1 мл раствора А прибавляют 0,5мл разведенной серной кислоты и титруют 0,1 М раствором перманганата калия до слабо-розового окрашивания.
1 мл 0,1 М раствора перманганата калия соответствует 0,0017012 г перекиси водорода, которой в препарате должно быть 2,7 • 3,3 %.
5Н202 + 2КМп04 + 3H2S04 «= 2MnSO4 + 502 + KaSO4 + 8Н20
Э = М.м/2
2. ЙОДОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ основано на окислительных свойствах перекиси водорода: 1 мл раствора А помещают в колбу с притертой пробкой, прибавляют 0,2 г йодида калия, 5 мл разведенной серной кислоты, оставляют на 10 мин в темном месте, выделившийся под титруют 0,1 М раствором тиосульфата натрия до обесцвечивания (индикатор —- крахмал).
1 мл 0,1 М раствора тиосульфата натрия соответствует 0,001701 г перекиси водорода.
Рассчитывают по формуле (в процентах):
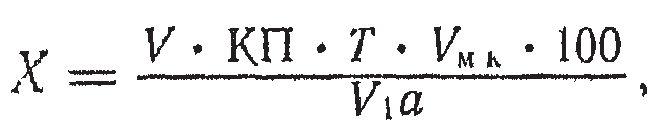
где V— количество титрованного раствора, израсходованного на титрование, мл; КП — коэффициент поправки; Т — титр определяемого вещества, г/мл; V— объем лекарственной формы, взятой для анализа, мл; а — объем разведения, взятый на определение, мл; Vмк -объем мерной колбы, в которой производили разведение, мг.
Бензоат натрия. К 10 мл препарата прибавляют 15—20 мл эфира, каплю раствора метилового оранжевого и каплю раствора метиленового синего, титруют 0,05 М раствором хлористоводородной кислоты до фиолетовой окраски водного слоя (при взбалтывании).
1 мл 0,05 М раствора хлористоводородной кислоты соответствует 0,007505 г бензоата натрия, которого в препарате должно быть 0,0425—0,0575 г.
C6H5COO-Na+ +НС1 = С6Н5СООН + NaCI
эфир
Э = М. м
Расчет ведут по формуле (в процентах):
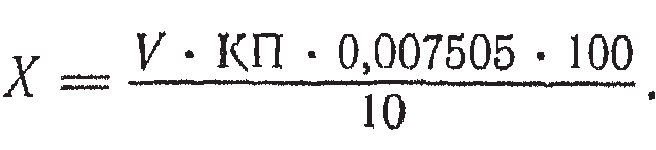
Date: 2015-05-09; view: 4211; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |