
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные законы термодинамики
|
|
Термодинамика – это учение о связи и взаимопревращениях различных видов энергии, теплоты и работы.
Термодинамика - наука о наиболее общих тепловых свойствах макроскопических тел.
Термодинамика основана на термодинамическом методе, в котором макроскопический объект (макросистема) рассматривается как сплошная среда, не имеющая внутренней структуры, и для характеристики этого объекта используется понятие «состояние».
Состояние макросистемы характеризуется некоторым количеством величин – параметров.
Термодинамические параметры – это физические величины, служащие для характеристики состояния системы.
Эти величины (параметры) характеризуют всю систему в целом. Предполагается, что во всех точках среды все эти параметры одинаковы, т.е. в классической термодинамике рассматриваются только равновесные состояния.
Равновесное состояние (состояние термодинамического равновесия) – такое состояние, которое не изменяется с течением времени, т.е. такое состояние, в которое при неизмененных внешних условиях приходит система и остается в нем сколь угодно долго.
При изменении внешних условий будет изменяться состояние системы – система будет совершать термодинамический процесс.
Термодинамический процесс называется равновесным, если система в этом процессе проходит через непрерывную последовательность равновесных состояний (равновесным может быть только бесконечно медленный процесс). Реальный процесс изменения состояния системы тем ближе к равновесному, чем медленнее он осуществляется.
Термодинамика, наука о наиболее общих свойствах макроскопических систем, находящихся в состоянии термодинамического равновесия, и о процессах перехода между этими состояниями.
С использованием термодинамического метода еще в 18 веке были экспериментально установлены количественные соотношения между параметрами, характеризующими состояние газа. Какие это параметры? Давление P, объем V, температура T, масса m.
1. Закон Бойля–Мариотта, закон Шарля, закон Гей-Люссака, объединенный газовый закон 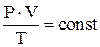 и уравнение Менделеева–Клапейрона
и уравнение Менделеева–Клапейрона 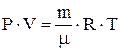 .
.
Термодинамика основывается на нескольких фундаментальных законах, называемых началами термодинамики, установленных на основании обобщения большого числа опытных данных. Поэтому выводы термодинамики имеют весьма общий характер.
Введём основные величины, используемые в термодинамике.
Внутренняя энергия тела включает в себя кинетическую энергию хаотического движения молекул, потенциальную энергию взаимодействия молекул, энергию электронных оболочек атомов и ионов, энергию движения и взаимодействия нуклонов в атомных ядрах. Обозначается внутренняя энергия 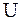 и измеряется в джоулях (Дж). Внутренняя энергия системы тел равна сумме внутренних энергий каждого из тел и энергии их взаимодействия.
и измеряется в джоулях (Дж). Внутренняя энергия системы тел равна сумме внутренних энергий каждого из тел и энергии их взаимодействия.
Внутренняя энергия – функция состояния системы. Это значит, что:
1. Всякий раз, когда система оказывается в данном состоянии, ее внутренняя энергия принимает присущее этому состоянию значение независимо от предыстории системы.
2. Изменение внутренней энергии системы при переходе из одного состояния в другое всегда равно разности значений внутренней энергии в этих состояниях и не зависит от пути, по которому совершался этот переход, т.е. не зависит от процессов, приведших к переходу из одного состояния в другое.
3. Если в результате какого-либо процесса система возвращается в исходное состояние, то изменение ее внутренней энергии равно нулю.
Внутренняя энергия системы зависит от температуры и фазового состояния системы.
Изменение внутренней энергии системы может осуществляться двумя способами: 1) путем совершения работы, 2) путем теплообмена.
Количество теплоты 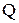 - это энергия, отдаваемая или получаемая в процессе теплопередачи. Теплообмен между телами или частями одного тела обусловлен различием их температур.
- это энергия, отдаваемая или получаемая в процессе теплопередачи. Теплообмен между телами или частями одного тела обусловлен различием их температур.
Величина совершенной работы 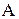 и количество переданной теплоты
и количество переданной теплоты 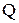 зависит от вида процесса при переходе системы из одного состояния в другое, т.е. от того, через какие промежуточные состояния проходит система.
зависит от вида процесса при переходе системы из одного состояния в другое, т.е. от того, через какие промежуточные состояния проходит система.
1-е начало термодинамики: Количество теплоты, сообщенное системе, расходуется на изменение внутренней энергии системы и на совершение системой работы против внешних сил 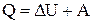 .
.
Если система получает тепло извне, то  , если отдает, то
, если отдает, то 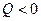 . Если работу совершает система, то
. Если работу совершает система, то 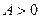 , если работу совершают внешние силы, то
, если работу совершают внешние силы, то 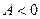 .
.
Первое начало можно записать для малого изменения состояния системы (для элементарного процесса) 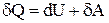 , где
, где 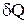 - элементарное количество тепла,
- элементарное количество тепла, 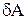 - элементарная работа,
- элементарная работа, 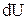 - приращение внутренней энергии.
- приращение внутренней энергии.
Отметим, что 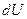 - полный дифференциал, т.к. при совершении любого процесса, в результате которого система возвращается в исходное состояние, изменение ее внутренней энергии равно нулю
- полный дифференциал, т.к. при совершении любого процесса, в результате которого система возвращается в исходное состояние, изменение ее внутренней энергии равно нулю 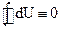 . Теплота и работа таким свойством не обладают, поэтому
. Теплота и работа таким свойством не обладают, поэтому 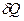 и
и 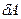 не являются полными дифференциалами.
не являются полными дифференциалами.
Работа, совершаемая системой при переходе из состояния 1 в состояние 2, равна алгебраической сумме работ 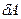 , совершаемых на всех малых участках
, совершаемых на всех малых участках 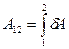 .
.
 Рассчитаем работу, совершаемую газом при расширении. Процесс считаем равновесным, т.к. газ находится в термодинамическом равновесии с окружающей средой, и его давление
Рассчитаем работу, совершаемую газом при расширении. Процесс считаем равновесным, т.к. газ находится в термодинамическом равновесии с окружающей средой, и его давление 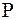 равно внешнему давлению. Пусть газ находится в сосуде под поршнем площадью
равно внешнему давлению. Пусть газ находится в сосуде под поршнем площадью 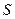 . Сила, с которой газ действует на поршень
. Сила, с которой газ действует на поршень 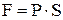 . Элементарная работа, совершаемая газом при перемещении поршня на величину
. Элементарная работа, совершаемая газом при перемещении поршня на величину 
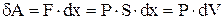 , где
, где 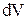 - изменение объема газа.
- изменение объема газа.
Давление газа всегда положительно 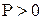 . Поэтому при расширении
. Поэтому при расширении 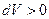 работа газа
работа газа 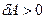 , а при сжатии (
, а при сжатии (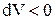 ) работа газа
) работа газа 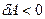 . В этом случае положительную работу над газом совершают внешние силы.
. В этом случае положительную работу над газом совершают внешние силы.
Формула 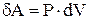 справедлива не только для газа, но для жидкости и твердого тела при расширении или сжатии под влиянием внешнего давления, равномерно распределенного по всей поверхности тела.
справедлива не только для газа, но для жидкости и твердого тела при расширении или сжатии под влиянием внешнего давления, равномерно распределенного по всей поверхности тела.
При конечных изменениях объема тела 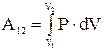 .
.
Работу при равновесных термодинамических процессах удобно изображать графически. Пусть система переходит из состояния 1 в состояние 2. Элементарная работа 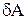 измеряется площадью заштрихованной полоски. Полная работа, совершаемая системой за весь процесс, измеряется площадью, ограниченной кривой 1-2, осью абсцисс и ординатами
измеряется площадью заштрихованной полоски. Полная работа, совершаемая системой за весь процесс, измеряется площадью, ограниченной кривой 1-2, осью абсцисс и ординатами 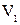 и
и 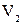 .
.
 При переходе системы из состояния 1 в состояние 2 общее количество теплоты, сообщаемое системе, равно алгебраической сумме теплот
При переходе системы из состояния 1 в состояние 2 общее количество теплоты, сообщаемое системе, равно алгебраической сумме теплот 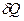 , полученных на всех малых участках процесса
, полученных на всех малых участках процесса 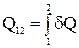 . Тепловые свойства тел, характеризуются теплоемкостью.
. Тепловые свойства тел, характеризуются теплоемкостью.
Теплоемкость тела – это отношение сообщаемой телу теплоты 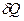 к соответствующему изменению температуры тела
к соответствующему изменению температуры тела 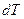
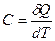 .
.
Измеряется теплоемкость тела в Дж/К и зависит от массы тела, химического состава тела, от температуры и от вида процесса.
Удельная теплоемкость 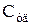 – величина, численно равная количеству теплоты, которое нужно сообщить единице массы вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе
– величина, численно равная количеству теплоты, которое нужно сообщить единице массы вещества для изменения его температуры на 1К в рассматриваемом термодинамическом процессе 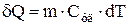 ,
, 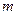 - масса тела. Единицей измерения
- масса тела. Единицей измерения 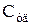 в СИ является Дж/кг·К.
в СИ является Дж/кг·К.
Молярная теплоемкость 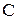 численно равна количеству теплоты, которое нужно сообщить 1молю вещества для изменения его температуры на 1К в данном термодинамическом процессе
численно равна количеству теплоты, которое нужно сообщить 1молю вещества для изменения его температуры на 1К в данном термодинамическом процессе 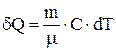 . Единицей измерения
. Единицей измерения 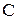 в СИ является Дж/моль·К.
в СИ является Дж/моль·К.  - молярная масса.
- молярная масса.
Удельная и молярная теплоемкости связаны друг с другом соотношением 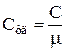 .
.
С учетом полученных формул для работы и теплоты 1-е начало термодинамики можно записать в виде 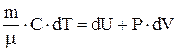 .
.
Применим 1-е начало термодинамики к изопроцессам идеального газа: изохорному, изобарному, изотермическому.
1) Изохорный процесс 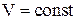 .
.
Практически осуществляется изохорный процесс при нагревании или охлаждении газа в сосуде постоянного объема. Изменение объема газа 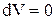 . Следовательно,
. Следовательно, 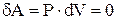 , т.е. в этом процессе газ не совершает работы. В этом случае из 1-го начала термодинамики следует, что вся теплота, сообщаемая газу, идет на изменение его внутренней энергии
, т.е. в этом процессе газ не совершает работы. В этом случае из 1-го начала термодинамики следует, что вся теплота, сообщаемая газу, идет на изменение его внутренней энергии 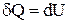 . Таким образом,
. Таким образом, 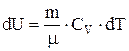 , где
, где 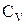 - молярная теплоемкость газа при постоянном объеме. Приращение внутренней энергии газа при изменении его температуры от
- молярная теплоемкость газа при постоянном объеме. Приращение внутренней энергии газа при изменении его температуры от 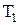 и
и 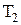
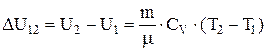 . Соответственно теплота, сообщаемая газу
. Соответственно теплота, сообщаемая газу 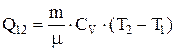 . При
. При 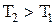 теплота подводится к газу, при
теплота подводится к газу, при 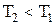 теплота отводится от газа.
теплота отводится от газа.
Поскольку 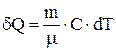 ,
, 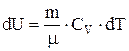 и
и 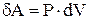 , то 1-е начало термодинамики для любого равновесного процесса идеального газа можно записать в виде
, то 1-е начало термодинамики для любого равновесного процесса идеального газа можно записать в виде 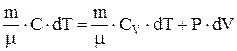 .
.
2) Изобарный процесс 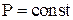 .
.
Осуществляется изобарный процесс при нагревании или охлаждении газа в цилиндре с подвижным поршнем, на который действует постоянное внешнее давление. Элементарное количество теплоты, сообщаемое газу в изобарном процессе  , где
, где 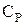 - молярная теплоемкость газа при постоянном давлении.
- молярная теплоемкость газа при постоянном давлении.
 Из уравнения Менделеева-Клапейрона при
Из уравнения Менделеева-Клапейрона при 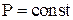 получаем
получаем 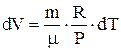 , поэтому элементарная работа, совершаемая газом в изобарном процессе
, поэтому элементарная работа, совершаемая газом в изобарном процессе 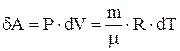 . В этом случае 1-е начало термодинамики
. В этом случае 1-е начало термодинамики  , и после сокращения
, и после сокращения 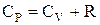 . Это уравнение Майера. Оно выражает связь между теплоемкостями идеального газа при постоянном давлении и при постоянном объеме.
. Это уравнение Майера. Оно выражает связь между теплоемкостями идеального газа при постоянном давлении и при постоянном объеме. 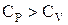 , т.к. в изобарном процессе, в отличие от изохорного, теплота, сообщаемая газу, расходуется не только на изменение внутренней энергии, но и на совершение работы.
, т.к. в изобарном процессе, в отличие от изохорного, теплота, сообщаемая газу, расходуется не только на изменение внутренней энергии, но и на совершение работы.
Работа, совершаемая газом при изобарном процессе 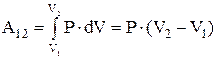 . Теплота, сообщается газу в изобарном процессе
. Теплота, сообщается газу в изобарном процессе 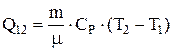 .
.
3) Изотермический процесс 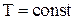 .
.
Примерами изотермических процессов являются процессы кипения, конденсации, плавления.
Поскольку 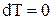 , то
, то 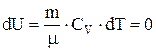 , т.е. внутренняя энергия газа не изменяется при изотермическом процессе. Следовательно,
, т.е. внутренняя энергия газа не изменяется при изотермическом процессе. Следовательно, 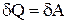 , т.е. вся теплота, сообщенная газу, расходуется на совершение газом работы против внешних сил.
, т.е. вся теплота, сообщенная газу, расходуется на совершение газом работы против внешних сил. 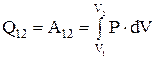 . Подставим в это уравнение давление, выраженное из уравнения Менделеева-Клапейрона,
. Подставим в это уравнение давление, выраженное из уравнения Менделеева-Клапейрона, 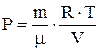 . Получим
. Получим 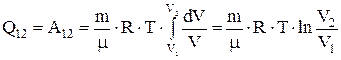 . При расширении газа
. При расширении газа 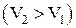 , работа, совершаемая газом
, работа, совершаемая газом 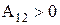 . Это означает, что для расширения газа при постоянной температуре к газу нужно подводить тепло
. Это означает, что для расширения газа при постоянной температуре к газу нужно подводить тепло 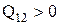 . При сжатии газа
. При сжатии газа 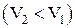 работа, совершаемая газом
работа, совершаемая газом 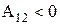 . Это означает, что для изотермического сжатия газа от газа нужно отводить тепло.
. Это означает, что для изотермического сжатия газа от газа нужно отводить тепло.
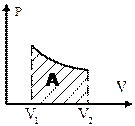 Теплоемкость газа при изотермическом процессе
Теплоемкость газа при изотермическом процессе 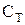 бесконечно велика, т.к. при
бесконечно велика, т.к. при 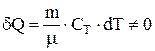 и
и 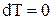
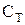 может быть равно только
может быть равно только 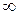 .
.
Адиабатным называется процесс, при котором отсутствует теплообмен между термодинамической системой и окружающей средой. Условие адиабатного процесса 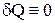 .
.
Этот процесс используется в двигателях внутреннего сгорания, холодильных установках. Адиабатный процесс осуществляется при достаточно быстром расширении или сжатии газа, так что теплообмен между газом и окружающей средой не успевает произойти. Из 1-го начала термодинамики следует, что при адиабатном процессе 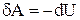 . Это значит, что работа совершается системой за счет убыли ее внутренней энергии. В случае идеального газа,
. Это значит, что работа совершается системой за счет убыли ее внутренней энергии. В случае идеального газа, 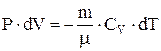 . Отсюда видно, что при адиабатном расширении
. Отсюда видно, что при адиабатном расширении 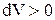 , т.е.
, т.е. 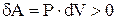 , а
, а 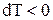 , т.е. газ охлаждается. При адиабатном сжатии
, т.е. газ охлаждается. При адиабатном сжатии 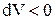 , т.е.
, т.е. 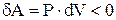 , а
, а 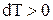 , т.е. газ нагревается.
, т.е. газ нагревается.
Теплоемкость газа при адиабатном процессе 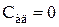 , поскольку при
, поскольку при 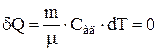 и
и 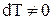
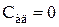 .
.
Найдем связь между параметрами идеального газа в адиабатном процессе. 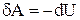 , или
, или 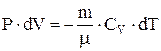 , или
, или 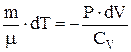 . Из уравнения Менделеева-Клапейрона при дифференцировании получаем
. Из уравнения Менделеева-Клапейрона при дифференцировании получаем 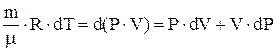 . Следовательно,
. Следовательно, 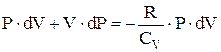 . Или
. Или 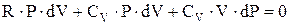 . С учетом уравнения Майера, получим
. С учетом уравнения Майера, получим 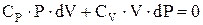 . Отсюда
. Отсюда 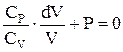 . Величину
. Величину 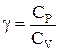 называют показателем адиабаты. Интегрируя полученное уравнение, получаем связь между давлением и объемом идеального газа при адиабатном процессе
называют показателем адиабаты. Интегрируя полученное уравнение, получаем связь между давлением и объемом идеального газа при адиабатном процессе  .
. 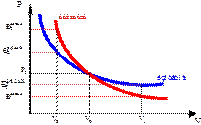
Это уравнение Пуассона или уравнение адиабатного процесса. График адиабатного процесса показан на рисунке. Показатель адиабаты 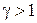 , поэтому адиабата идет круче изотермы, иначе говоря при адиабатном расширении температура газа уменьшается, следовательно, давление газа падает быстрее, чем при изотермическом расширении.
, поэтому адиабата идет круче изотермы, иначе говоря при адиабатном расширении температура газа уменьшается, следовательно, давление газа падает быстрее, чем при изотермическом расширении.
Воспользовавшись уравнением Менделеева-Клапейрона уравнение адиабатного процесса можно выразить через другие параметры идеального газа 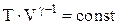 или
или 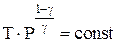 .
.
Работа, совершаемая идеальным газом при адиабатном процессе может быть найдена из условия 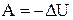 или
или 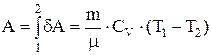 , или
, или 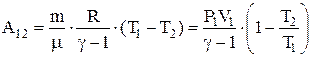 .
.
Внутренняя энергия идеального газа складывается из кинетической энергии его отдельных молекул. Если молекула имеет 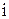 степеней свободы, то ее средняя кинетическая энергия
степеней свободы, то ее средняя кинетическая энергия 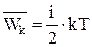 . Тогда внутренняя энергия 1 моля идеального газа
. Тогда внутренняя энергия 1 моля идеального газа 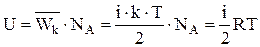 , где
, где 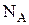 - число Авогадро и
- число Авогадро и 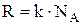 .
.
Молярная теплоемкость идеального газа при постоянном объеме 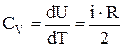 , а при постоянном давлении
, а при постоянном давлении 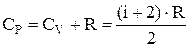 . Тогда показатель адиабаты
. Тогда показатель адиабаты 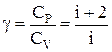 .
.
1-е начало термодинамики устанавливает общий баланс энергии при различных ее превращениях, но ничего не говорит о том, в каких направлениях будут происходить эти превращения при различных условиях. Оно не говорит, возможно ли в действительности какое-либо определенное превращение энергии. Выполнение 1-го начала – необходимое, но не достаточное условие того, чтобы какое-либо превращение было возможно. На все эти вопросы отвечает 2-е начало термодинамики, которое является обобщением огромного числа опытных данных.
2-е начало термодинамики: невозможен процесс, единственным конечным результатом которого был бы переход тепла от тела, менее нагретого, к телу, более нагретому (Клаузиус). Это значит, что теплота “сама собой” не может переходить от более холодного тела к более нагретому телу. Для этого необходим компенсирующий процесс – совершение работы.
Введем некоторые понятия.
Приведенное количество тепла – это отношение количества тепла 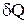 , полученного термодинамической системой от какого-либо тела (нагревателя), к температуре этого тела
, полученного термодинамической системой от какого-либо тела (нагревателя), к температуре этого тела 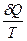 . Можно показать, что для любого обратимого цикла приведенное количество тепла, сообщаемое системе на всех участках цикла, равно нулю
. Можно показать, что для любого обратимого цикла приведенное количество тепла, сообщаемое системе на всех участках цикла, равно нулю 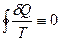 . Отсюда следует, что стоящее под интегралом выражение
. Отсюда следует, что стоящее под интегралом выражение 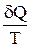 , в отличие от
, в отличие от 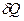 , является полным дифференциалом некоторой функции
, является полным дифференциалом некоторой функции 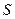 , которая называется энтропией системы
, которая называется энтропией системы 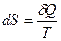 . Величины
. Величины 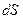 и
и 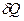 имеют один и тот же знак, поэтому по характеру изменения энтропии можно судить о направлении процесса теплообмена: при нагревании системы ее энтропия возрастает, при охлаждении – убывает.
имеют один и тот же знак, поэтому по характеру изменения энтропии можно судить о направлении процесса теплообмена: при нагревании системы ее энтропия возрастает, при охлаждении – убывает.
Поскольку величина 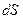 является полным дифференциалом, изменение энтропии при всяком обратимом, но не круговом процессе, не зависит от вида процесса, а зависит только от начального и конечного состояний системы. Следовательно, энтропия – функция состояния.
является полным дифференциалом, изменение энтропии при всяком обратимом, но не круговом процессе, не зависит от вида процесса, а зависит только от начального и конечного состояний системы. Следовательно, энтропия – функция состояния. 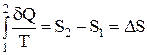 , где
, где 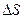 - приращение энтропии.
- приращение энтропии.
1-е начало термодинамики для идеального газа можно записать в виде 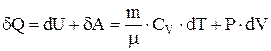 . Отсюда
. Отсюда 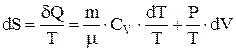 . Выражая давление газа
. Выражая давление газа 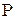 из уравнения Менделеева-Клапейрона, находим
из уравнения Менделеева-Клапейрона, находим 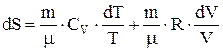 . Интегрируя это выражение, находим
. Интегрируя это выражение, находим 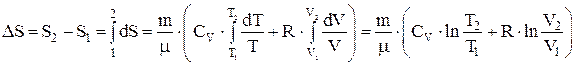 . Энтропия идеального газа возрастает с ростом температуры и объема газа.
. Энтропия идеального газа возрастает с ростом температуры и объема газа.
При адиабатном процессе 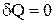 и, значит,
и, значит, 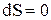 , т.е.
, т.е. 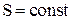 . Это значит, что энтропия системы не меняется. Другими словами, адиабаты – это линии равной энтропии – “изэнтропические” линии.
. Это значит, что энтропия системы не меняется. Другими словами, адиабаты – это линии равной энтропии – “изэнтропические” линии.
Количественным выражением 2-го начала термодинамики является принцип возрастания энтропии: энтропия изолированной системы может только возрастать (если в системе протекает необратимый процесс) или оставаться постоянной (если в системе протекает обратимый процесс). 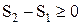 ,
, 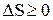 .
.
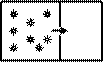 2-е начало термодинамики с точки зрения молекулярно-кинетической теории. Процессы, связанные с тепловым движением молекул отличаются от механического движения тем, что они обычно бывают необратимыми. Совокупность частиц способна только к необратимым изменениям. Причиной является грандиозность числа частиц и полная хаотичность их движений. Например, газ, находившийся первоначально в одной половине сосуда, разделенного перегородкой с отверстием, распространяется равномерно по всему сосуду.
2-е начало термодинамики с точки зрения молекулярно-кинетической теории. Процессы, связанные с тепловым движением молекул отличаются от механического движения тем, что они обычно бывают необратимыми. Совокупность частиц способна только к необратимым изменениям. Причиной является грандиозность числа частиц и полная хаотичность их движений. Например, газ, находившийся первоначально в одной половине сосуда, разделенного перегородкой с отверстием, распространяется равномерно по всему сосуду.
Обратный же переход газа никогда не произойдет без постороннего вмешательства. Иначе говоря, вероятность самопроизвольного обращения теплового процесса столь мала, что необратимость тепловых процессов можно считать принципиальной.
Необратимый процесс можно определить как процесс, обратный которому весьма маловероятен.
С величиной термодинамической вероятности 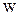 может быть связана энтропия, т.к. обе величины возрастают при необратимых процессах и имеют максимальное значение в состоянии равновесия. Это выражает формула Больцмана
может быть связана энтропия, т.к. обе величины возрастают при необратимых процессах и имеют максимальное значение в состоянии равновесия. Это выражает формула Больцмана 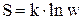 .
.
Больцман дал статистическую формулировку 2-го начала термодинамики: в изолированной системе при обратимых процессах вероятность состояния не изменяется, при необратимых процессах вероятность состояния возрастает. Наиболее вероятным изменением энтропии является ее возрастание.
| <== предыдущая | | | следующая ==> |
| | | Основы термодинамики |
Date: 2015-05-09; view: 988; Нарушение авторских прав