
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первый закон термодинамики. Первый закон термодинамики – это принцип сохранения и превращения энергии в применении к процессам, сопровождающимися выделением или поглощением теплоты
Первый закон термодинамики – это принцип сохранения и превращения энергии в применении к процессам, сопровождающимися выделением или поглощением теплоты, а так же совершением или затратой работы и изменением внутренней энергии системы.
Предположим, что некоторая система за счёт поглощения из внешней среды теплоты переходит из состояния I в состояние II. В общем случае эта теплота расходуется на изменение внутренней энергии системы DU и на совершение работы против внешних сил А:
Q=DU+А, где DU=Uкон.-Uнач., А=РDV=Р(Vкон.-Vнач.)
Величина Q считается положительной, если теплота поглощается системой, и отрицательной, если теплота выделяется; работа А считается положительной, если система совершает работу, и отрицательной, если работа затрачивается на систему; DU считается положительной, если внутренняя энергия системы возрастает, и отрицательной, если она убывает.
ПРИМЕР 1. Найти изменение внутренней энергии при испарении 10 г воды при 20 °С и давлении 1×105 Па, приняв, что пары воды подчиняются законам идеальных газов и объём воды незначителен по сравнению с объёмом пара, теплота парообразования воды равна 40,700 кДж/моль.
| Дано: | Решение: 1) Записываем термохимическое уравнение парообразования воды Н2 О(ж.)=Н2О(п.)-40,7кДж/моль 2) Используя I закон термодинамики находим DU: Q=DU +А; DU =Q-А; А=РDV; DU =Q- РDV 3) Определяем количество вещества испарившейся воды. |
| m(НО2)=10г Т=293 К Р=1×105 Па Qпар.=40,7 кДж/моль | |
| DU -? |
 ;
; 
4) Зная, что теплота парообразования – это количество теплоты, поглощённой при испарении 1 моль вещества, определяем количество теплоты, поглощённой системой при испарении 0,56 моль воды:
При испарении 1 моль воды – поглощается 40,7 кДж теплоты;
При испарении 0,56 моль воды – поглощается Q теплоты.
Составляем пропорцию и находим Q:
 , откуда
, откуда 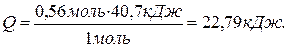
5) Определяем объём пара, образующийся при испарении 0,56 моль воды, используя уравнение Клайперона-Менделеева:
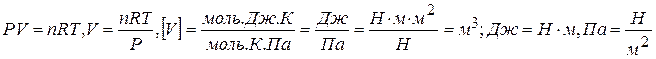
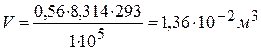
6) Находим работу расширения пара:
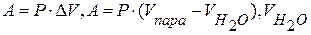 - можно пренебречь, тогда
- можно пренебречь, тогда

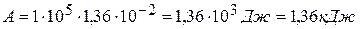
7) Определяем изменение внутренней энергии:
DU=22,79 кДж-1,36 кДж=21,43 кДж
Ответ: DU=21,43 кДж.
ЗАДАЧИ:
1. Найти изменение внутренней энергии при испарении 250 г бензола при температуре 25 °С и давлении 1×105 Па, приняв, что пары бензола подчиняются законам идеальных газов и объём бензола незначителен по сравнению с объёмом пара. Теплота парообразования бензола равна 30,800 кДж/моль.
2. Найти изменение внутренней энергии при испарении 30 г воды при температуре 50 °С и давления 1×105 Па, приняв, что пары воды подчиняются законам идеальных газов и объём воды незначителен по сравнению с объёмом пара. Теплота парообразования воды равна 40,700 кДж/моль.
3. Найти изменение внутренней энергии при испарении 100 г бензола при температуре 80 °С и давления 1×105 Па, приняв, что пары бензола подчиняются законам идеальных газов и объём бензола незначителен по сравнению с объёмом пара. Теплота парообразования воды равна 30,800 кДж/моль.
3. Расчёт тепловых эффектов реакций по теплотам образования реагентов
Химические реакции можно проводить или при постоянном объёме (V=const) – изохорный процесс, или при постоянном давлении (P=const) – изобарный процесс.
При изохорном процессе, поскольку изменение объёма системы не происходит, то A=0, тогда первый закон термодинамики примет вид:
Q=DU+A, A=PDV; DV=0, поэтому A=0 Qv=DU
Следовательно, если химическая реакция протекает при постоянном объёме, то выделение или поглощение теплоты Qv (тепловой эффект реакции) связано с изменением внутренней энергии системы.
Для химического процесса, протекающего изобарически, изменение объёма представляет собой разность между суммой объёмов продуктов реакции и суммой объёмов исходных веществ, тогда тепловой эффект реакции (Qp) равен:
Qp=DU+ PDV, Qp=(U2- U1)+P(V2-V1) или DU= U2- U1, DV= V2-V1,
p=(U2+ PV2)-(U1+PV1), введём обозначение U+PV=H, тогда Qp=H2-H1, Qp=DH
Величину Н называют ЭНТАЛЬПИЕЙ (теплосодержанием).
Таким образом, если при постоянном объёме тепловой эффект реакции равен внутренней энергии системы, то в случае постоянного давления тепловой эффект реакции равен изменению энтальпии системы.
Поскольку подавляющее большинство химических реакций проходит при постоянном давлении, то в дальнейшем основное внимание будем уделять изобарным процессам.
Непосредственное измерение энтальпии затруднено, поэтому применительно к каждой реакции говорят об изменении энтальпии DН. Стандартная энтальпия реакции обозначается как 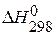 .
.
Знаки тепловых эффектов и изменений энтальпий для одной и той же реакции противоположны, т.е. для экзотермической реакции Q>0, DН0<0, для эндотермической реакции Q<0, DН0>0.
Рассмотрим процесс образования жидкой воды из газообразных водорода и кислорода.
При использовании термохимического правила знаков уравнения следует записывать следующим образом:
2Н2(г.)+О2(г.)=2Н2О(ж.)+571,6 кДж.
При использовании термодинамического правила знаков уравнение следует записывать следующим образом:
2Н2(г.)+О2(г.)=2Н2О(ж.); 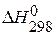 = –571,6 кДж.
= –571,6 кДж.
Стандартные энтальпии образования различных соединений – это табличные данные. Энтальпии образования простых веществ в наиболее устойчивой при данных условиях модификации равны нулю

Расчёт тепловых эффектов реакций ( ) по теплотам образования как и многие другие термодинамические расчёты, осуществляются на основе осново-полагающего закона термодинамики, вытекающего из закона сохранения энергии – закона ГЕССА.
) по теплотам образования как и многие другие термодинамические расчёты, осуществляются на основе осново-полагающего закона термодинамики, вытекающего из закона сохранения энергии – закона ГЕССА.
ТЕПЛОВОЙ ЭФФЕКТ РЕАКЦИИ ЗАВИСИТ ТОЛЬКО ОТ СОСТОЯНИЯ ИСХОДНЫХ ВЕЩЕСТВ И ПРОДУКТОВ РЕАКЦИИ И НЕ ЗАВИСИТ ОТ ПУТИ ПРЕВРАЩЕНИЯ ВЕЩЕСТВ, Т.Е. ОТ НАЛИЧИЯ И ВИДА ПРОМЕЖУТОЧНЫХ РЕАКЦИЙ, ЧЕРЕЗ КОТОРЫЕ МОЖЕТ ПРОТЕКАТЬ ИТОГОВАЯ РЕАКЦИЯ.
Проиллюстрируем закон на примере растворения безводной соли CuSO4 и её кристаллогидрата.

 ;
; 
Таким образом, тепловой эффект реакции, протекающий в одну стадию равен сумме тепловых эффектов реакций, протекающих в две стадии.
Но нас в большей степени будут интересовать следствия из закона Гесса:
1 следствие.
Тепловой эффект химической реакции равен разноси сумм тепловых эффектов образования продуктов реакции и исходных веществ с учётом стехиометрических коэффициентов.

2 следствие.
Тепловой эффект разложения какого-либо соединения равен и противоположен по знаку тепловому эффекту его образования. 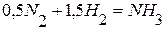 .
.
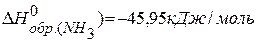 ;
; 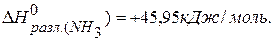
3 следствие.
Если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным состояниям, то разность между тепловыми эффектами реакций представляет собой тепловой эффект перехода из одного конечного состояния в другое.
4 следствие.
Если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным состояниям, то разность между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
5 следствие.
Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции с учётом стехиометрических коэффициентов:

ПРИМЕР 1. Найти изменение энтальпии реакции ( )
)
СО(г.)+Н2О(ж.)=СО2(г.)+ Н2(г.), если известны теплоты образования соединений: 
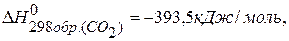

| Дано: | Решение:
1) Напишем исходное уравнение реакции: СО2(г.)+Н2О(ж.)=СО2(г.)+Н2(г.)
2) Используя 1 следствие из закона Гесса
находим  : :
|
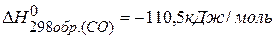
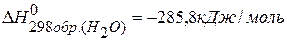
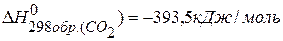
| |
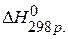 -? -?
|
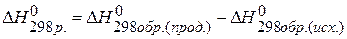

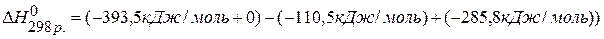

Ответ: 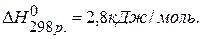
ПРИМЕР 2. Найти тепловой эффект реакции 
СО(г.)+0,5О2(г.)=СО2(г.), если известны тепловые эффекты следующих реакций: С(графит)+О2(г.)=СО2(г.), 
С(графит)+0,5О2(г.)=СО(г.), 
| Дано: | Решение:
1) Напишем исходное уравнение реакции: СО(г.)+0,5О2(г.)=СО2(г.), 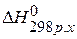 2) Используя 3 следствие из закона Гесса
2) Используя 3 следствие из закона Гесса
|


| |
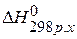 -? -?
|
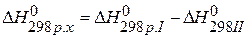
 , значит урав-
, значит урав-
нение СО(г.)+0,5О2(г.)=СО2(г.) можно получить, если из первого уравнения вычесть второе: С(графит)+О2(г.)-С(графит)-0,5О2(г.)=СО2(г.)-СО(г.), получаем СО(г.)+0,5О2(г.)=СО2(г.), 
Ответ: 
ПРИМЕР 3. Найти тепловой эффект реакции С(графит)=С(алмаз), если известны тепловые эффекты следующих реакций:
С(графит)+О2(г.)=СО2(г.), 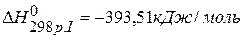 , С(алмаз)+О2(г.)=СО2(г.),
, С(алмаз)+О2(г.)=СО2(г.),  .
.
| Дано: | Решение:
1) Напишем исходное уравнение реакции: С(графит)=С(алмаз), 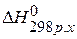 2) Используя 4 следствие из закона Гесса
2) Используя 4 следствие из закона Гесса

|
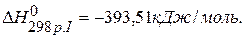
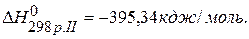
| |
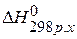 -? -?
|
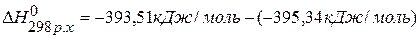

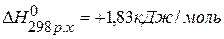 , значит С(графит)=С(алмаз),
, значит С(графит)=С(алмаз), 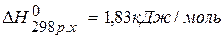 .
.
Ответ: 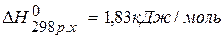
ПРИМЕР 4. Найти тепловой эффект реакции  , если известны теплоты сгорания соединений:
, если известны теплоты сгорания соединений: 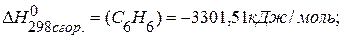

| Дано: | Решение:
1) Напишем исходное уравнение реакции:  , , 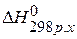 2) Используя 5 следствие из закона Гесса
2) Используя 5 следствие из закона Гесса
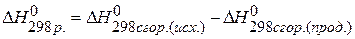
|


| |
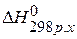 -? -?
|

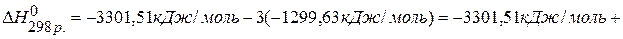

Ответ: 
Для нахождения тепловых эффектов реакций можно использовать значения энергии связи, тогда

ПРИМЕР 5. Определить тепловой эффект реакции, протекающей в газовой фазе по энергиям связей:  ,
, 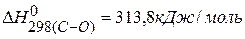 ,
, 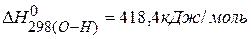 ,
,
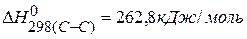 ,
, 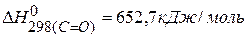 ,
, 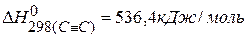 .
.
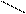
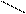 СН3 СН3
СН3 СН3

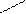
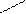 С=О + СНºСН = С – СºСН
С=О + СНºСН = С – СºСН
СН3 СН3 ОН
| Дано: | Решение:
1) Запишем исходное уравнение реакции:
  СН3 СН3 СН3 СН3
   С=О + СНºСН= С – СºСН, СН3 СН3 ОН С=О + СНºСН= С – СºСН, СН3 СН3 ОН
 2) Используя выше описанное правило находим
2) Используя выше описанное правило находим 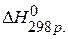 : :
 
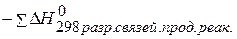
|
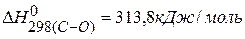
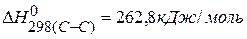
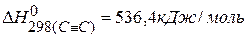
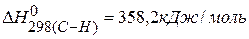
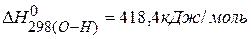
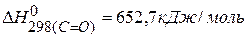
| |
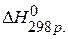 -? -?
|
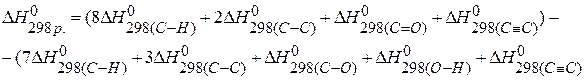


Ответ: 
ЗАДАЧИ:
1. Найти изменение энтальпии реакции  , если
, если  ,
, 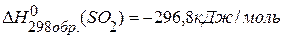 ,
, 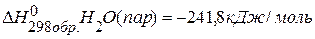 .
.
2. Вычислить изменение энтальпии реакции  , если
, если  ,
,  ,
,  .
.
3. Найти энтальпию образования  , если изменение энтальпии реакции
, если изменение энтальпии реакции  равно –1366,745 кДж,
равно –1366,745 кДж, 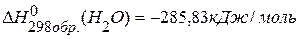 ,
,  .
.
4. Определить энтальпию образования этилена, если изменение энтальпии реакции  равно –1323кДж,
равно –1323кДж,  ,
, 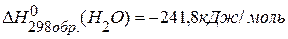 .
.
5. Определить тепловой эффект реакции 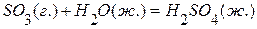 , если известны эффекты следующих реакций:
, если известны эффекты следующих реакций:
 ,
,  ,
,  ,
,  .
.
6. Определить тепловой эффект следующих реакций:


 , если известны тепловые эффекты следующих реакций:
, если известны тепловые эффекты следующих реакций:
 ,
, 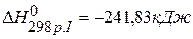 ,
, 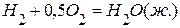 ,
, 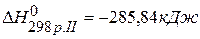 ,
,  ,
,  .
.
7. Определить тепловой эффект реакции
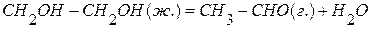 , если известны теплоты сгорания:
, если известны теплоты сгорания: 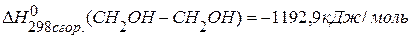 ,
, 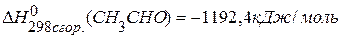 ,
,  .
.
8. Определить тепловой эффект реакции
 , если известны тепловые эффекты образования веществ:
, если известны тепловые эффекты образования веществ: 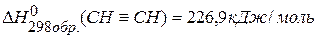 ,
, 
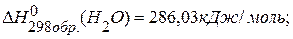
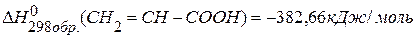 .
.
9. определить тепловой эффект реакции задачи №8, если известны тепловые эффекты сгорания веществ: 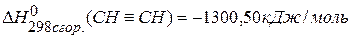 ,
, 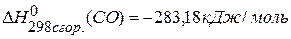 ,
, 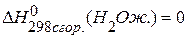 ,
, 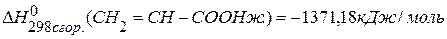 .
.
10. Определить тепловой эффект сгорания метилацетата по энергии разрыва связей:
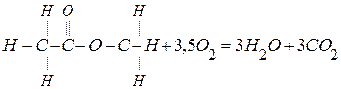 ,если
,если 
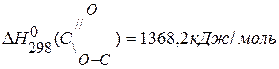 ,
, 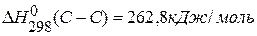 ,
,  ,
,  ,
,  .
.
11. Определить теплоту образования  , если изменение энтальпии реакции
, если изменение энтальпии реакции 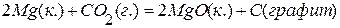 равно –810,1 кДж,
равно –810,1 кДж, 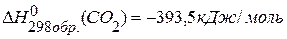 .
.
4. Расчёт тепловых эффектов реакций при помощи системы термохимических
Date: 2015-05-09; view: 475; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |