
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Первое начало Т-Д применимо к любой конечных размером макросистемы
|
|
Ограничение: только системы и конечные размеры!
5.1 Процесс изохорные протекают при постоянном объеме.
Возьмем сосуд с идеальным газом и закрепим поршнем
Рисунок
Рисунок
dQ=dU+dA
В случае изохорного процесса V=const сл-но dV=0 т.к. dA= 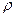 dV=0
dV=0
dQ=dU –все тепло пойдет на изменение внутренней энергии 
Принтегрируем
 Q=
Q= 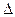 U
U
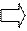 dQ=
dQ= 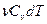 dU=
dU= 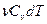 - изменение внутренней энергии
- изменение внутренней энергии
dQ=dU
получено для изохорного, но справедливо для любого равновесного процесса происходящие с газами
проинтегрируем получим
U= 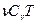
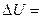
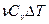 - изменение в энергии Сv-малярная теплоемкость =
- изменение в энергии Сv-малярная теплоемкость = 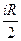 сл-но
сл-но 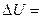

5.2 Внутренняя энергия идеального газа не зависит от V, а зависит только от t/
Значимость закона заключается в том что позволит в Т-Д определить идеальный газ.
Газ подчиняется законам Джоуля считается идеальным.
В 1843—50 Джоуль экспериментально показал, что теплота может быть получена за счёт механической работы, и определил механический эквивалент теплоты, дав тем самым одно из экспериментальных обоснований закона сохранения энергии. В 1851, рассматривая теплоту как движение частиц, теоретически определил теплоёмкость некоторых газов. Совместно с У. Томсоном опытным путём установил, что при медленном стационарном адиабатическом протекании газа через пористую перегородку температура его изменяется (см. Джоуля — Томсона эффект).
Для постановки опыта Джоуль – Томсон использовали следующее оборудование:
1. Теплоизолированная цилиндрическая трубка, разделенная на две части с помощью пористого материала – дросселя.
2. Два термометра.
3. Два манометра.
4. Баллон с исследуемым газом.
5. Редукционный клапан. Это устройство, автоматически перепускающее жидкость или газ из полости высокого давления в полость более низкого давления с поддержанием постоянного давления в одной из этих полостей.
6. Соединительные трубки.
5.3 Теперь поршнем не закреплен. Если будем нагревать сл-но объем возрастет до тех пор пока 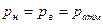
Первое начало термодинамики dQ=dU+dA
Интегральная форма 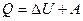

Т.к. процесс изобарный p=const 
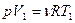


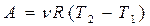
Если 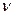 =1 моль
=1 моль 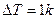 ;
;
Универсальная газовая постоянной R численно равна изобарному расширения 1 моля идеального газа при повышении температуры на 1 Кельвин.
5.4 Понятие об энтальпии
dA=pdV=d(pV)
dQ=dU+d(pV)
dQ=d(U+pV)-является полноценным дифференциалом
H=U+pV – тепловая функция или энтальпии
dQ=dH проинтегрируем получим 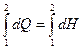
Q= 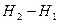 Кол-во теплоты сообщенное даст изменение энтальпии.
Кол-во теплоты сообщенное даст изменение энтальпии.
Энтальпии можно определить как функцию состояния приращение которой равно кол-во теплоты полученной системой при изобарном.
Относится к термодинамическим потенциалом. Как связаны теплоемкости связаны.
5.5 Уравнение Майнера.
Кол-во теплоты которое сообщено газу при изобарном процессе можно вычислить 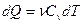 тогда
тогда 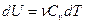
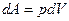
Подставим в первое начало Т-Д.
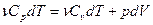
Состояние идеального газа
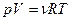 продифференцируем
продифференцируем
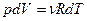 получается
получается 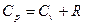 - устанавливается зависимость между молярной и изобарной
- устанавливается зависимость между молярной и изобарной
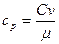
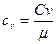 удельная теплоемкость равна
удельная теплоемкость равна 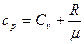
5.6 Зависит только от температуры внутренняя энергия dT=0
dU=0
dQ=dA
Теплота пойдет на совершение работы. Изотермический будет проходить при постоянном нагревании.
Термостат – теплоемкость тела огромна и поддерживает t постоянно.
Первое начало Т-Д сл-но 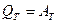
Чему тогда равно работа?
dA=pdV
Уравнение идеального газа pV= 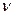 RT
RT
p=  dA=
dA=  dV проинтегрируем
dV проинтегрируем
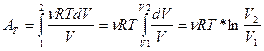 сл-но
сл-но 
Закон Боля-Мариота 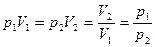
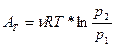
рисунок
У каждого состояния есть значение внутренней энергии.
5.7 Адиабатическим процессом – наз. такой процесс при котором отсутствует телообмен с окружающей средой
1 способ получения окружить теплоизоляцией(термос(сосуд Диара))
2способ провести опыт быстро что бы теплообмен не успел пройти
dQ=dU+dA
dQ=0
0=dU+dA
dU=-dA - система использует свою температуру.
При адиабатном процессе изменяются все три параметра. Такие уравнения были получены их пишут через 2 неизвестных переменных уравнения Пуассона.
5.7 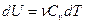
dA=pdV -из этих двух формул следует 
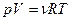
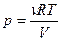 подставим
подставим
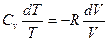
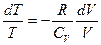
R= 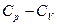 - подставим
- подставим
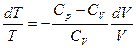 ;
; 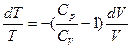
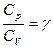 – коэффициент Пуассона (коэф. Адиабатического процесса, адиабатическая постоянная, показатель адиабаты)
– коэффициент Пуассона (коэф. Адиабатического процесса, адиабатическая постоянная, показатель адиабаты)
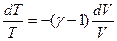 интегрируем ln T = -(
интегрируем ln T = -(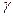 -1)lnV+c
-1)lnV+c
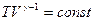 -уравнение Пуассона в переменных ТV
-уравнение Пуассона в переменных ТV
Воспользуемся уравнением Клаперона.
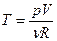 подставим
подставим 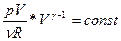 уравнение Пуассона в переменных ТV
уравнение Пуассона в переменных ТV
5.8 График
Как будет выглядит адиабата рассмотрим произвольно у какого процесса dv>dp будет круто
Продифференцирует
pdV+Vdp=0
pdV=-Vdp
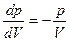
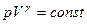 дифференцируем
дифференцируем
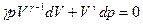
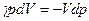
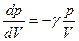 - означает что тепла нужно больше (увелич. энергия и совер. работы)
- означает что тепла нужно больше (увелич. энергия и совер. работы)
5.9 Изменение работы при изменении внутренней энергии
dA=-dU
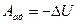
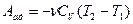
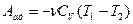
5.10 Часто бывает процессы при которых теплоемкость газа остается постоянной – это политропные процессы.
Все выше описанные процессы яв. политропными наз. такие процессы при которых теплоемкость Т-Д системы остается постоянной.
Исследовав их физики доказали что для них давление и объем всегда связаны функциональной зависимостью формула, где n – показатель политропны.
Теплоемкость политропного процесса связана с показателем политропы след. соотношение 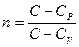 n- показатель политропы
n- показатель политропы
С –теплоемкость политропы
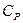 - молярная изобарная теплоемкость
- молярная изобарная теплоемкость
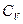 - молярная изохорная теплоемкость
- молярная изохорная теплоемкость
1)Рассмотрим изобарный процесс
P=const
n=0 сл-но V=1
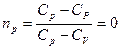
2) Рассмотрим изотермические
T=const pV=cjnst
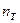 =1
=1
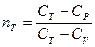
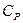 ≠
≠ 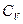 отличаются только на постоянную
отличаются только на постоянную
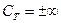
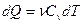 (неопределенное кол-во теплоты)
(неопределенное кол-во теплоты)
3Рассмотрим изохорный
V=const
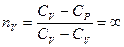
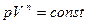
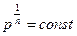
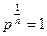 сл-но
сл-но 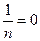 сл-но
сл-но 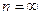
4)адиабатический процесс
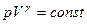
n= 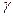 - показателю политропы
- показателю политропы
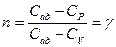 сл-но
сл-но 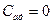
Мы рассмотрели 4 политропных процесса
Date: 2015-05-09; view: 399; Нарушение авторских прав