
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Третье начало термодинамики. сформулированный В. Нерстом в 1906 году (тепловой закон Нернста), согласно которому энтропия S любой системы стремится к конечному для неё пределу
|
|
сформулированный В. Нерстом в 1906 году (тепловой закон Нернста), согласно которому энтропия S любой системы стремится к конечному для неё пределу, не зависящему от давления, плотности или фазы, при стремлении температуры (Т) к абсолютному нулю.
Третье начало термодинамики позволяет находить абсолютное значения энтропии, что нельзя сделать на основе первого и второго начал термодинамики. В классической термодинамике (первого и второго начал) энтропия может быть определена лишь с точностью до произвольной аддитивной постоянной S0, что практически не мешает большинству термодинамических исследований, так как реально измеряется разность энтропий (S0) в различных состояниях. Согласно третьему началу термодинамики при Т ® 0 значение DS ® 0.
М. Планк в 1911 году дал другую формулировку третьего начала термодинамики - как условие обращения в нуль энтропии всех тел при стремлении температуры к абсолютному нулю:
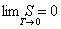
| (1.8) |
Отсюда S 0 = 0. Это даёт возможность определять абсолютное значения энтропии и других термодинамических потенциалов.
Формулировка Планка соответствует определению энтропии в статистической физике через термодинамическую вероятность (W) состояния системы S = k ln W.
При абсолютном нуле температуры система находится в основном квантово-механическом состоянии, если оно невырождено, для которого W = 1 (состояние реализуется единственным микрораспределением. Следовательно, энтропия S при Т = 0 равна нулю. В действительности при всех измерениях стремление энтропии к нулю начинает проявляться значительно раньше, чем может стать существенной при T → 0 дискретность квантовых уровней макроскопической системы, приводящая к явлениям квантового вырождения.
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достигнуть ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться.
Date: 2015-05-09; view: 463; Нарушение авторских прав