
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Астана, 2014г
|
|
По дисциплине «Биофизика» Fis 1113
Специальность: 5В110300 «Фармация»
Тема №1: Термодинамические потенциалы. Организм, как открытая система. Термометрия и калориметрия.
Количество часов: 1
Курс: 1
Составители: Калиева Ж.А.
Астана, 2014г.
Обсуждено и утверждено на заседании кафедры
Протокол № ______ от «____»________________ 2014г.
Зав.кафедрой _____________ Асемова Г.Д.
(подпись) Ф.И.О.
Обсуждено и утверждено на заседании кафедры
Протокол № ______ от «____»________________ 20__г.
Зав.кафедрой _____________ __________________
(подпись) Ф.И.О.
Обсуждено и утверждено на заседании кафедры
Протокол № ______ от «____»________________ 20__г.
Зав.кафедрой _____________ __________________
(подпись) Ф.И.О.
Обсуждено и утверждено на заседании кафедры
Протокол № ______ от «____»________________ 20__г.
Зав.кафедрой _____________ __________________
(подпись) Ф.И.О.
Обсуждено и утверждено на заседании кафедры
Протокол № ______ от «____»________________ 20__г.
Зав.кафедрой _____________ __________________
(подпись) Ф.И.О.
1. Тема №2: Термодинамические потенциалы. Организм, как открытая система. Термометрия и калориметрия.
2. Цель занятия: Изучить основные термодинамические понятия, первое и второе начало термодинамики, термодинамические особенности живых систем, изменение энтропии в биологических системах в норме и патологии.
3. Задачи обучения: изучить основные термодинамические понятия и законы, термодинамические особенности живых систем, изменение энтропии в биологических системах в норме и патологии, вычислять энтропию системы, применять основные закономерности термодинамических процессов в исследовательской практике.
4. Форма проведения: практическая работа:
1. Собеседование по вопросам темы.
1. Работа студентов по выполнению индивидуальных заданий.
2. Анализ работы студентов, оценка работы.
5. Задания по теме:
1. Чему равен общий баланс энтропии живого организма в стационарном состоянии?
2. Назовите основные различия между стационарным состоянием термодинамической системы и состоянием равновесия.
3. Изменение энтропии при расширении 1 моля закиси азота от 10л при постоянной температуре составляет 5,8 Дж/К. Каков конечный объем газа?
4. При какой температуре находилось 2 моль воды в сосуде, если при ее нагревании до 1000 произошло увеличение энтропии на 23,5 Дж/К?
6. Раздаточный материал: методическая разработка, набор индивидуальных заданий.
7. ЛИТЕРАТУРА:
1. Ремизов А.Н. Медицинская биологическая физика.М.: Дрофа, 2004,
глава 7.
2. Ремизов А.Н. Курс физики, 1982г. Глава 10, § 2,4,5,6,8.
3. Ливенцев Н.М. Курс физики,1978г. Т.1, § 17,18,19,20.
4. Владимиров Ю.А. Биофизика,1983г. Глава 1, § 1.1, 1.3, 1.10.
5. Ремизов А.Н. Медицинская биологическая физика 1987,1996, 2003, глава 12 §12.1 - 12.9.
6. Губанов Н.И. Медицинская биофизика,1978г. Глава 2.
8. Контрольные вопросы для заключительного контроля знаний:
1. Термодинамический метод изучения биологических систем.
2. Первое начало термодинамики. Внутренняя энергия.
3. Второе начало термодинамики.
4. Энтропия свободная энергия, электрохимический потенциал.
Свободная энергия и равновесие.
5. Организм как открытая система. Теорема Пригожина. Сравнение
термодинамического равновесия и стационарного состояния.
6. Критика теории "тепловой смерти" Вселенной.
7. Использование повышенных и пониженных температур в медицине.
Тестовые задания:
1. Термодинамическая система изолирована, если она:
А) не обменивается с окружающей средой ни веществом, ни энергией;
В) обменивается с окружающей средой веществом, не обменивается энергией;
С) обменивается с окружающей средой энергией, не обменивается веществом;
Д) обменивается с окружающей средой и веществом, и энергией;
Е) обменивается с окружающей средой веществом и информацией.
2. Термодинамическая система называется закрытой, если она:
А) не обменивается с окружающей средой ни веществом, ни энергией;
В) обменивается с окружающей средой веществом, не обменивается энергией;
С) обменивается с окружающей средой энергией, не обменивается веществом;
Д) обменивается с окружающей средой и веществом, и энергией;
Е)обменивается с окружающей средой веществом и информацией.
3. Параметры термодинамической системы, зависящие от массы, называются:
А) термодинамическими;
В) экстенсивными;
С) интенсивными;
Д) независимыми;
Е) зависимыми.
4. В состояние термодинамического равновесия все параметры
А) меняются со временем
В)не меняются со временем
С)экстенсивные
Д)интенсивные
Е)независимые
5. Математическая формулировка I закона термодинамики
А) F = U - TS;
В) G = U + pV - TS;
С) 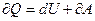 ;
;
Д) dF = -SdT - pdV;
Е) 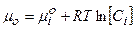 .
.
6. Второй закон термодинамики гласит, что
А) внутреннюю энергию тела можно изменить работой или теплопередачей.
В) теплота не может самостоятельно переходить от холодного тела к горячему.
С) теплообмен происходит только между нагретыми телами.
Д) мощность теплообмена между телами зависит от разности их температур.
Е) тела, хорошо излучающие энергию, будут и хорошо ее поглощать.
7. В изолированной системе энтропия в равновесных процессах
А) равна нулю
В) постоянна
С) возрастает
Е) убывает
8. Термодинамической вероятностью называется
А) число возможных микросостояний системы, которыми осуществляется данное макросостояние
В) вероятностное количество микрочастиц в системе
С) количество процессов протекающих в системе
Д) отношение числа микросостояний, которыми осуществляется данное состояние к общему числу всех микросостояний. характерных данной системе.
Е) нет верного определения
9. Энтропия системы является мерой
А) неупорядоченности процесса
В) макроскопического состояния
С) характера распределения частиц в системе
Д) уровня активности процессов текущих в системе
Е) нет правильного ответа
10. Укажите математический вид связи между энтропией и термодинамической вероятностью:
А) W = kБ · S;
В) S = kБ · ln W;
С) S = kБ · W2;
Д) W = - kБ · lnS;
Е) - S = n · e –W.
11. Полное изменение энтропии открытой системы складывается из:
А)dS = ¶Q/T;
В) dS = deS + diS;
С)dS = diS;
Д)dS = deS;
Е)dS = 1/I (TdS – dU – pdV).
12. По теореме Пригожина в частично – равновесной открытой системе в стационарном состоянии, близком к термодинамическому равновесию значение скорости прироста энтропии за счет внутренних необратимых процессов достигает:
А) отличного от бесконечности постоянного максимального положительного значения.
В) отличного от нуля постоянного минимального отрицательного значения.
С) постоянного максимального положительного значения.
Д) отличного от нуля постоянного минимального положительного значения.
Е) скорость прироста энтропии равна нулю и энтропия не изменяется.
Date: 2015-05-08; view: 570; Нарушение авторских прав