
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Идеального газа
|
|
Все газы подчиняются ранее приведенным газовым законам лишь приближенно, и тем менее точно, чем больше плотность газа ρ = m / V и чем ниже его температура. Газ, который в точности подчинился бы законам Бойля–Мариотта, Гей-Люссака и Авогадро, называют идеальным. Реальные газы приближенно соответствуют идеальному газу в области обычных давлений и плотностей.
Все процессы, о которых уже шла речь, и о которых будет говориться дальше, считаются протекающими очень медленно. Например, сжатие газа в цилиндре протекает столь плавно, что в любой момент времени успевает устанавливаться новое состояние теплового равновесия с новыми значениями давления и объема. Подобные процессы называются равновесными. Если после равновесного сжатия предоставить газу возможность столь же равновесно расширяться, то газ пройдет через ту же последовательность состояний теплового равновесия, что и при сжатии, но, естественно, в обратном порядке. По этой причине равновесные процессы называются обратимыми.
Реальные процессы не протекают бесконечно медленно, и фактически все они не обратимы. Представление об обратном процессе — такая же идеализация реальных процессов, как, например, материальная точкаидеализации реального тела в механике.
Важным свойством равновесных (обратимых) процессов является то, что они «не помнят», каким образом газ пришел в то или иное состояние, ведь все параметры — равновесные. Поэтому для вывода формулы связи любых двух состояний можно использовать удобные нам процессы.
Перейдем к установлению связей между тремя параметрами состояния р, V и Т при неизменном количестве газа ν = const. Переход удобно проводить, используя сначала изотермический, а затем изобарный процессы. Параметры р 1, V 1, T 1переходят сначала в р 2, V ʹ и Т 1, а затем уже в р 2, V 2и Т 2(рис. 1.3).
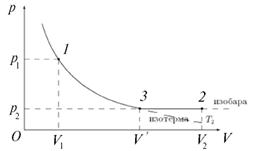
Рис. 1.3. Вывод уравнения состояния идеального газа
Переходя от состояния 1 к промежуточному удобному состоянию 3, характеристики которого наметим штрихом, имеем (по Бойлю–Мариотту):
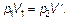 (1.14)
(1.14)
Переходя от промежуточного состояния 3 к конечному состоянию 2 по изобаре (по Гей-Люссаку), запишем:
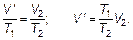 (1.15)
(1.15)
Исключая параметр промежуточного состояния V ʹ, получим
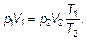 (1.16)
(1.16)
Теперь можно забыть о пути перехода, т. к. при обратимых процессах это не важно.
Записывая полученную формулу при T 1 = T 2(и по-прежнему количество вещества ν1 = ν2), получим закон изотермического процесса; записывая при р 1 = р 2, получим закон изобарного процесса. Эти законы уже были введены (см. (1.5) и (1.11)) и считались известными при выводе, а вот при V 1 = V 2(ν1 = ν2) получим новый, неиспользованный при выводе закон — закон изохорного процесса (рис. 1.4).
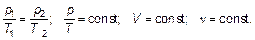 (1.17)
(1.17)
Date: 2015-05-08; view: 874; Нарушение авторских прав